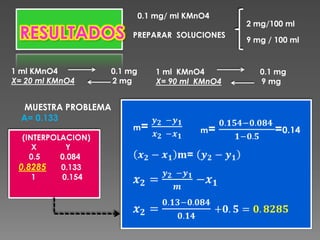
Este documento describe una práctica de laboratorio realizada por estudiantes de ingeniería química para aprender el uso de un espectrofotómetro y verificar la ley de Lambert-Beer. Los estudiantes prepararon soluciones de permanganato de potasio con diferentes concentraciones, midieron su absorbancia, y graficaron los resultados para construir una curva de calibración. Luego usaron la curva para determinar la concentración de una muestra desconocida.