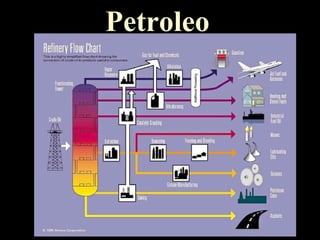
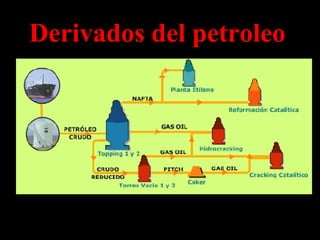
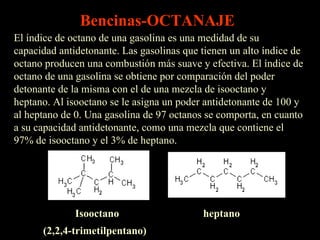
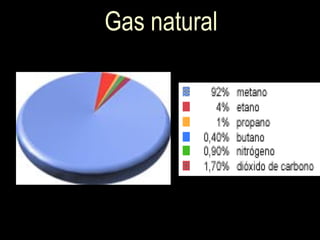
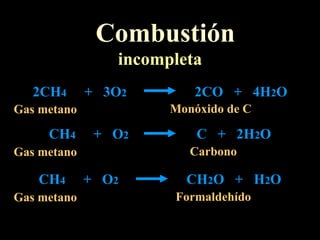
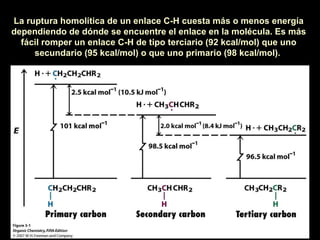
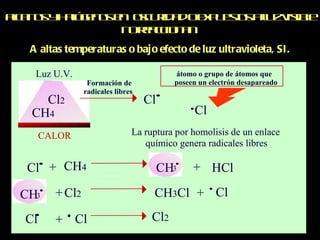
El documento trata sobre las fuentes naturales de hidrocarburos y sus reacciones y propiedades. Explica que el petróleo es una mezcla de hidrocarburos que se encuentra de forma natural en la tierra. También describe las reacciones de combustión de los alcanos, la formación de radicales libres y las reacciones de halogenación mediante la adición de cloro o bromo.