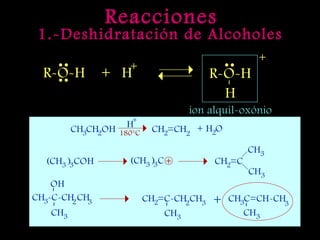
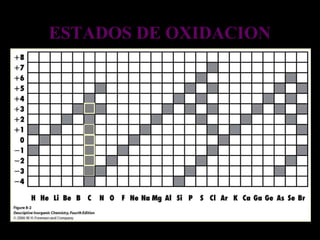
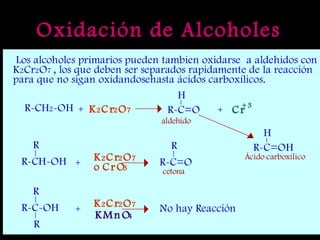
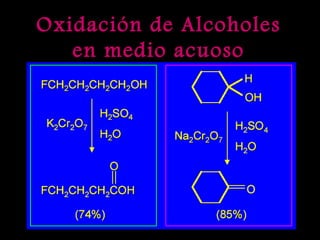
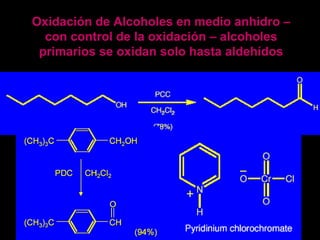
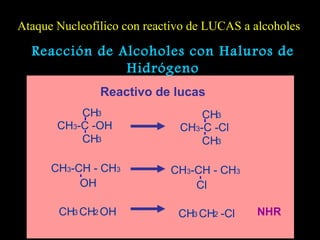
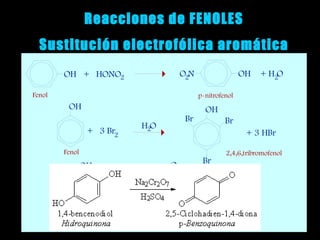
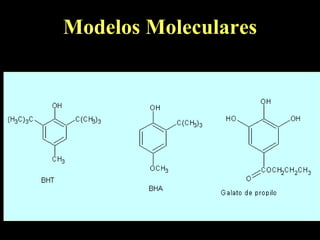
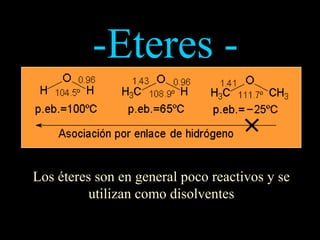
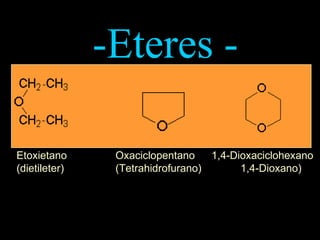
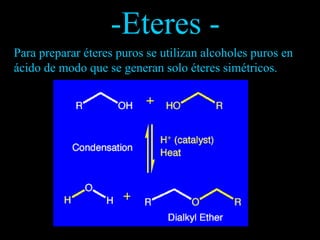
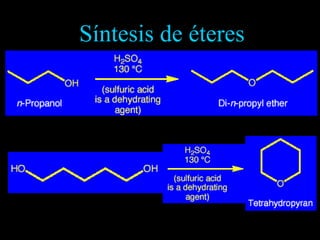
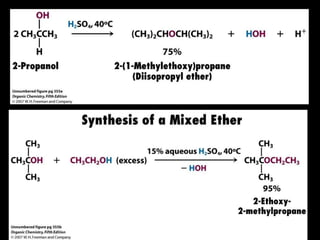
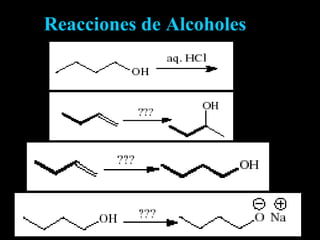
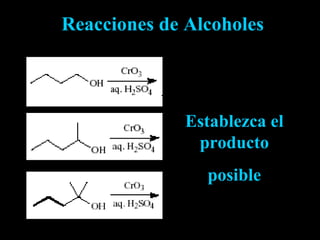
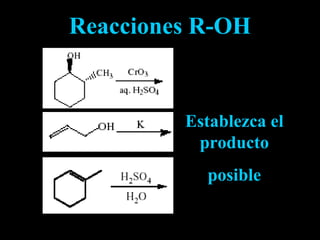
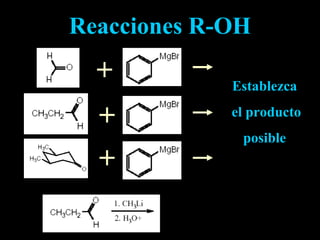
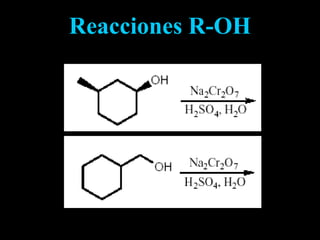
El documento proporciona una introducción a las reacciones de los alcoholes, incluyendo la deshidratación, oxidación y reacciones con haluros de hidrógeno. También describe métodos para determinar el alcohol en la sangre, como el método de Widmark, y propiedades y reacciones de otros compuestos relacionados como glicoles, fenoles y éteres.