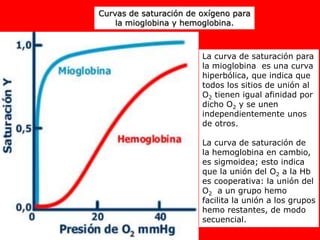
El documento describe la hemoglobina, una proteína transportadora de oxígeno en la sangre. Explica que la hemoglobina está compuesta de grupos hemo unidos a subunidades globina, y que puede unirse cooperativamente al oxígeno. También describe cómo factores como el pH, el 2,3-bisfosfoglicerato y la temperatura afectan la afinidad de la hemoglobina por el oxígeno.