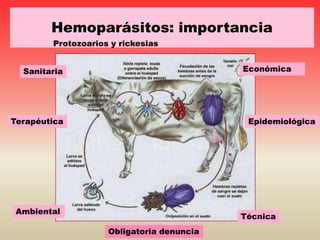
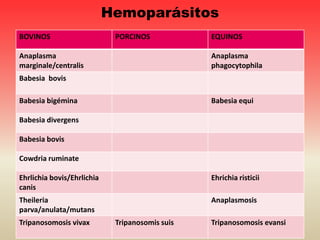
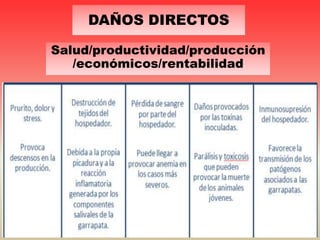
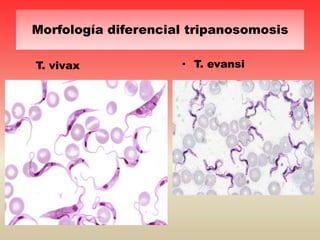
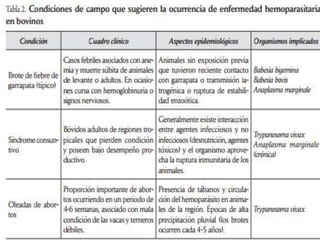
Este documento discute varios hemoparásitos que afectan a bovinos, porcinos y equinos. Describe las características, transmisión, síntomas, diagnóstico y tratamiento de enfermedades como la babesiosis, anaplasmosis, erhlichiosis y tripanosomiasis. También explica la importancia económica y epidemiológica de estos parásitos, así como los retos relacionados con el diagnóstico y control de las enfermedades que causan.