Incrustar presentación
Descargado 52 veces



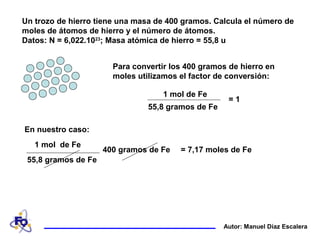



Un trozo de hierro de 400 gramos se utiliza para calcular el número de moles y átomos de hierro. Primero, se calcula que hay 7,17 moles de hierro dividiendo la masa del hierro entre su masa molar de 55,8 gramos. Luego, se multiplica el número de moles por el número de Avogadro para determinar que hay 4,32 x 1024 átomos de hierro.





