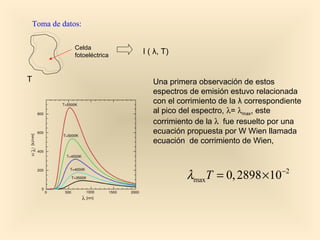
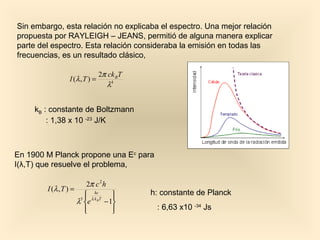
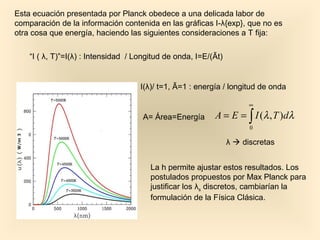
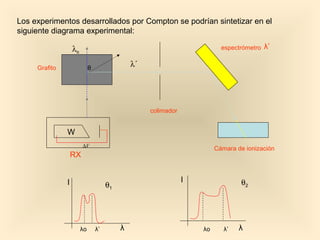
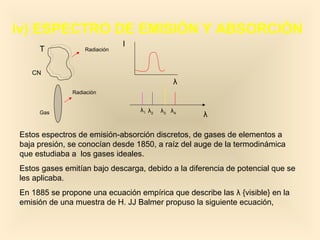
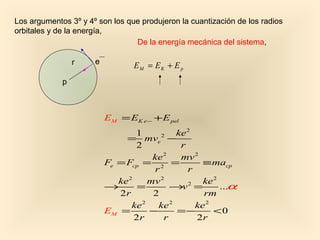
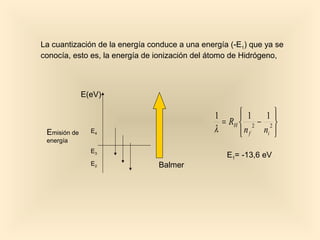
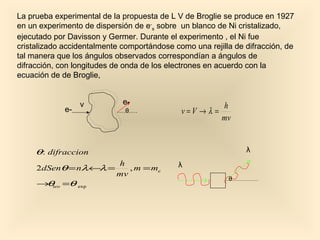
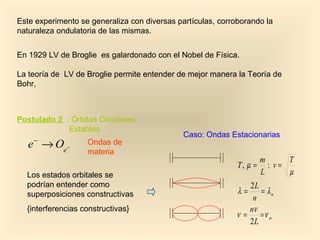
Este documento introduce conceptos fundamentales de la mecánica cuántica a través de fenómenos observados a finales del siglo XIX que no podían explicarse con la física clásica, como la radiación del cuerpo negro y el efecto fotoeléctrico. Explica cómo Planck, Einstein, Compton y otros desarrollaron nuevos modelos y teorías cuánticas para dar cuenta de estos fenómenos. También presenta el modelo atómico de Bohr, que introdujo la cuantización para explicar los espectros ató