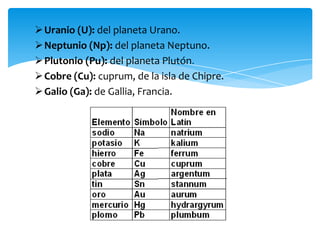
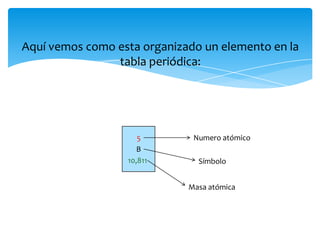
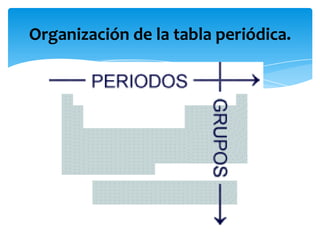
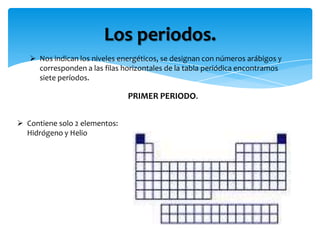
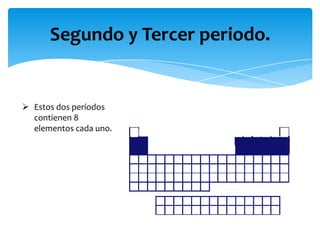
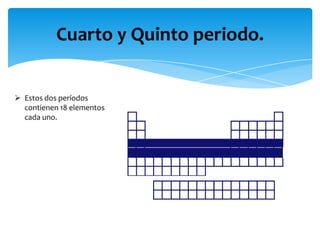
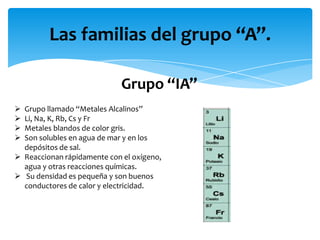
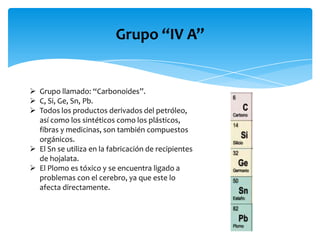
Este documento resume la tabla periódica, incluyendo la simbología y estructura de los elementos, grupos y períodos. Describe los 118 elementos conocidos, sus símbolos y propiedades químicas generales, así como la organización de la tabla en grupos verticales y períodos horizontales.