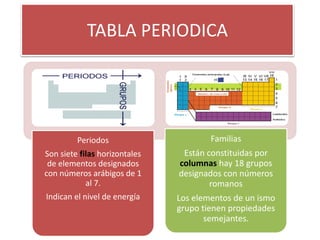
El documento describe las características principales de la tabla periódica. La tabla periódica contiene siete períodos horizontales que indican el nivel de energía de los elementos, y dieciocho grupos verticales cuyos elementos comparten propiedades similares. La configuración electrónica de los elementos determina su ubicación en la tabla periódica y las propiedades periódicas, como el radio atómico y la electronegatividad, varían de forma predecible a través de la tabla.