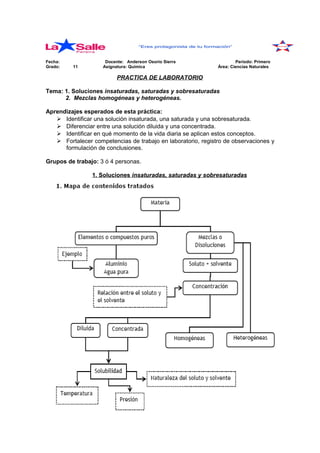
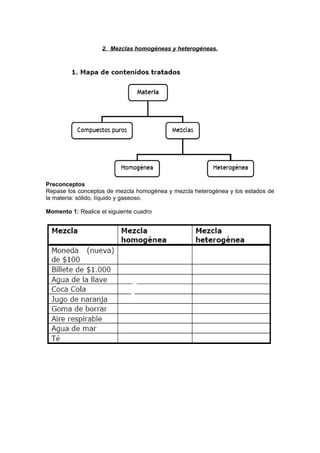
Este documento presenta una práctica de laboratorio sobre soluciones insaturadas, saturadas y sobresaturadas, y mezclas homogéneas y heterogéneas. La práctica guía a los estudiantes a través de experiencias para identificar diferentes tipos de soluciones y comprender cómo factores como la temperatura afectan la solubilidad. También los lleva a preparar y observar ejemplos de mezclas homogéneas y heterogéneas para reforzar la comprensión de estos conceptos.