Este documento presenta el contenido abreviado de una quinta edición de un libro de texto de microbiología. El libro contiene 11 partes que cubren diversos temas como la introducción a la microbiología, la estructura y función de células procariotas y eucariotas, el crecimiento y control microbiano, el metabolismo microbiano, la genética y biología molecular microbiana, la tecnología del DNA, los virus, la diversidad microbiana, la ecología y simbiosis microbiana, la respuesta inmunitaria y resistencia










![más grande en sedimentos oceánicos, Thiomargarita nami-
biensis (Recuadro 3.1). En definitiva, algunas bacterias tie-
nen un tamaño incluso mayor que la media de las células
eucariotas (las típicas células de plantas y animales presen-
tan un diámetro de 10-50 µm).
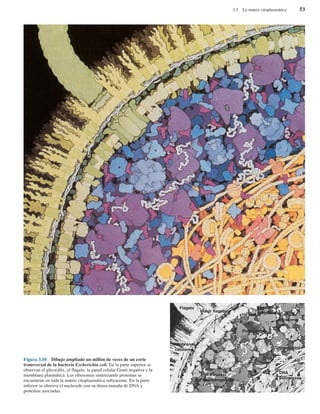
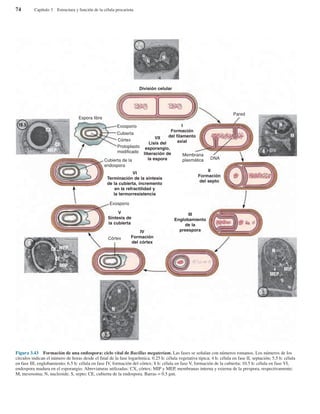
Organización de la célula procariota
Las células procariotas contienen numerosas estructuras.
Sus funciones principales se resumen en la Tabla 3.1, y la
Figura 3.4 ilustra muchas de ellas. No están todas las
3.1 Resumen de la estructura de la célula procariota 47
Recuadro 3.1
Microbios monstruosos
L
os biólogos han diferenciado a menudo las células proca-
riotas de las eucariotas por su tamaño. Generalmente, las
procariotas son más pequeñas que las eucariotas. Las
células procariotas crecen muy rápido en comparación con la
mayoría de las eucariotas, y carecen de los complejos sistemas
de transporte vesicular que poseen las células eucariotas (véase
el Capítulo 4). Se ha asumido que deben ser pequeñas por la
necesidad de una proporción mayor entre superficie y volumen,
y así, por ejemplo, favorecer la difusión intracelular de nutrien-
tes. Por ello, cuando Fishelson, Montgomery y Myrberg descu-
brieron un microorganismo grande, con forma de puro, en el
intestino del pez cirujano, Acanthurus nigrofuscus, propusieron
en su artículo publicado en 1985, que era un protista. Este micro-
organismo era demasiado grande para ser otra cosa. En 1993,
Esther Angert, Kendall Clemens y Norman Pace emplearon téc-
nicas para comparar secuencias de rRNA (p. 468) que les permi-
tieron identificar a este microorganismo, denominado actual-
mente Epulopiscium fishelsoni, como un procariota próximo al
género Gram positivo Clostridium.
E. fishelsoni [latín epulum, banquete, y piscium, pez] cuya
longitud es normalmente de 200 a 500 µm, puede alcanzar un
tamaño de 80 µm por 600 µm (véase la figura del recuadro).
Tiene, aproximadamente, un volumen mil veces superior al de
Escherichia coli. A pesar de su gran tamaño, este organismo
posee una estructura celular procariota. Es móvil y nada a una
velocidad de unas dos veces su longitud por segundo (aproxima-
damente, 2.4 cm/min) usando los flagelos de tipo bacteriano que
cubren su superficie. El citoplasma contiene nucleoides grandes
y muchos ribosomas, como sería necesario para una célula tan
grande. Epulopiscium puede superar los límites de tamaño esta-
blecidos para la difusión gracias a una membrana plasmática
muy plegada. Esto aumenta el área de la superficie celular y faci-
lita el transporte de nutrientes.
Parece que Epulopiscium se transmite de huésped a huésped
por contaminación fecal. La bacteria se puede eliminar dejando
en ayunas al pez cirujano durante unos días, aunque parece ser
que los adultos son resistentes, ya que si se colocan alevines
sanos junto a adultos infectados, los alevines se contagiarán,
pero no contagiarán a otros adultos sanos.
En 1997, Heidi Schulz descubrió en los sedimentos oceánicos
de la costa de Namibia un procariota aún más grande. Thiomarga-
rita namibiensis es una bacteria esférica, entre 100 y 750 µm de
diámetro, que a menudo forma cadenas. Es unas 100 veces más
grande en volumen que E. fishelsoni. Una vacuola ocupa cerca
del 98% de la célula, y contiene un fluido rico en nitratos; ésta
está rodeada de una capa de citoplasma de unos 0.5-2.0 µm llena
de gránulos de azufre. Esta capa citoplasmática es tan fina como
la que presentan la mayoría de las bacterias, para permitir tasas
adecuadas de difusión. La oxidación del azufre la utilizan como
fuente de energía, siendo el nitrato el aceptor de electrones.
El descubrimiento de estos procariotas limita en gran medi-
da la diferenciación entre procariotas y eucariotas en función de
su tamaño celular, ya que estos dos procariotas tienen un tamaño
mayor que una célula eucariota normal. Además, se ha descu-
bierto que algunas células eucariotas son más pequeñas de lo que
se pensaba. El mejor ejemplo es Nanochlorum eukaryotum.
Nanochlorum tiene sólo de 1 a 2 µm de diámetro, aunque es ver-
daderamente eucariota y tiene un núcleo, un cloroplasto y una
mitocondria. Es preciso evaluar de nuevo nuestros conocimien-
tos sobre los factores que limitan el tamaño de las células proca-
riotas. Ya no es seguro asumir que las células grandes son euca-
riotas y las pequeñas procariotas.
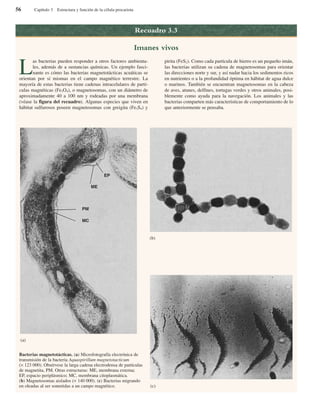
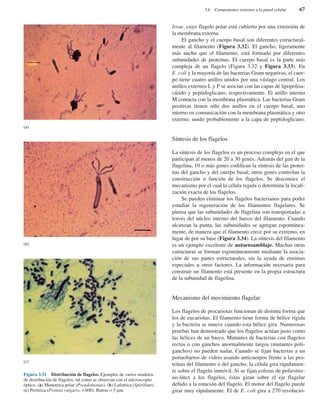
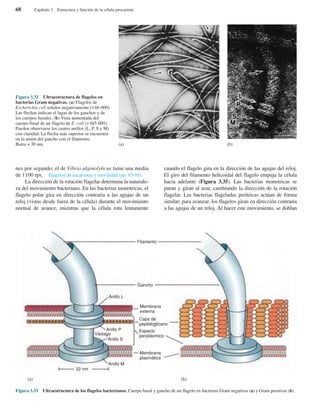
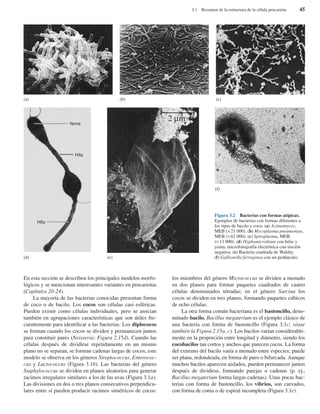
Bacterias gigantes. (a) Esta fotografía, realizada con
pseudoiluminación de campo oscuro, muestra a Epulopiscium
fishelsoni en la parte superior de la Figura, empequeñeciendo a los
paramecios que aparecen en la parte inferior (× 200). (b) Una
cadena de células de Thiomargarita namibiensis visualizadas
mediante microscopía óptica. Obsérvese la cubierta mucosa
externa, así como los glóbulos internos de azufre.
(a)
(b)](https://image.slidesharecdn.com/libroprescott-140805210519-phpapp02/85/Libro-Microbiologia-de-Lansing-Prescott-John-Harley-y-Donald-Klein-13-320.jpg)