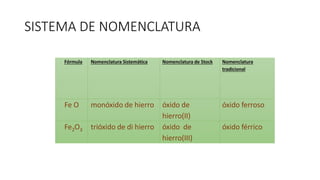
Este documento describe los óxidos, compuestos binarios formados por la combinación de un elemento con oxígeno que se encuentran de forma natural. Menciona varios óxidos importantes como la hematita, corindón y ópalo, e indica que los óxidos metálicos son básicos mientras que los no metálicos son ácidos. También resalta usos industriales de óxidos como el zinc y plomo, e importancia biológica de los óxidos de nitrógeno.