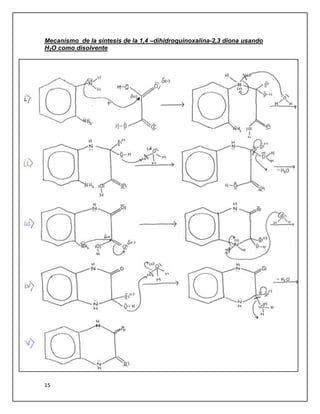
El objetivo del documento era sintetizar la 1,4-dihidroquinoxalina-2,3-diona a través de dos métodos y caracterizar los productos obtenidos. Se realizó la síntesis usando un equipo de reflujo con HCl 4N como solvente y horno microondas conectado a un equipo de reflujo con HCl 4N y agua como solventes. Ambos métodos produjeron cristales blancos que resultaron ser el mismo compuesto a través de cromatografía de capa fina. El método más efectivo