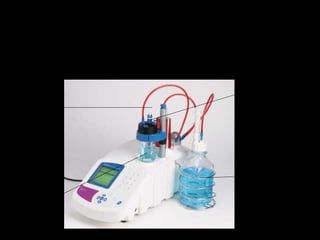
1) Los métodos potenciométricos miden el potencial eléctrico de un electrodo sumergido en una disolución para determinar la concentración de esta de forma directa o indirecta.
2) Existen varios tipos de potenciometría como directa, volumétrica y de oxido-reducción, dependiendo del tipo de reacción química involucrada.
3) La relación cuantitativa entre el potencial de una celda electroquímica y la concentración del analito se utiliza para realizar análisis potenciom



![Una reacción electroquímica tiene lugar en la interfase metal disolución
La reacción general es
aA + bB + .............. cC + dD +.........
E = Eo – (RT/nF) ln {[C]c
[D]d
/[A]a
[B]b
}
Si la medida del potencial es directa (caso de medida del pH)
E = Eo +(0,059/n )ln [A]a
Eo = constante
Medida del pH
pH= - log (H+
)
E = Eref – 0,059 log a H+
E = Eref – 0,059 (T/298) pH
E = Eref – 0,0001984 T pH](https://image.slidesharecdn.com/potenciometrateoria1-130605171548-phpapp02/85/Potenciometria-teoria-1-4-320.jpg)