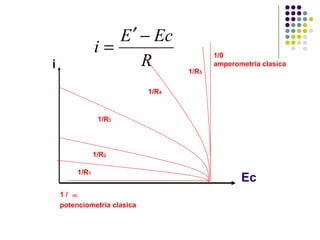
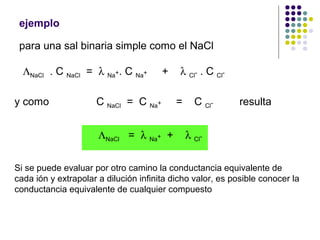
1) El documento introduce conceptos básicos del electroanálisis como circuitos electroquímicos, electrodos, métodos de medida como amperometría y potenciometría. 2) Explica la clasificación de métodos electroanalíticos directos que miden propiedades eléctricas como función de la concentración y métodos donde la corriente eléctrica es un reactivo. 3) Describe aspectos teóricos como la ley de Ohm aplicada a sistemas electroquímicos y la variación de la conductancia con la concentración para
















![Fundamentación teórica
Una reacción electroquímica es la que tiene lugar en la
interfase metal-disolución por medio de una transferencia
electrónica. Esa interfase constituye el electrodo.
Una reacción general como la siguiente:
aA + bB + ........ = cC + dD + .........
tiene asociada la energía necesaria para que el sistema
alcance el equilibrio y el electrodo adquiera un potencial
eléctrico dado según Nernst por:
RT [Cc] . [Dd] ........
E = Eo - ——— ln ———————
nF [Aa] . [Bb] ........](https://image.slidesharecdn.com/electroanlisis-130605171314-phpapp01/85/Electroanalisis-19-320.jpg)
![Al adoptarse la temperatura T=298 º K y luego de convertir
logaritmo natural en decimal, la expresión anterior adopta la
siguiente forma:
0,059 [Cc] . [Dd] ........
E = Eo - ——— log ———————
. n [Aa]
. [Bb] ........
Ecuación fundamental del análisis potenciométrico
Eo =0 para el hidrógeno, es mayor que cero si la reacción espontánea
procede de tal modo que pasan iones negativos a la disolución
De acuerdo a la IUPAC (International Union of Pure and Applied
Chemistry), la convención de los signos es la siguiente:
Los Eo son negativos con respecto al potencial normal de hidrógeno
cuando se trata de metales con mayor poder reductor que el hidrógeno
Los Eo serán positivos para elementos menos reductores que el
hidrógeno](https://image.slidesharecdn.com/electroanlisis-130605171314-phpapp01/85/Electroanalisis-20-320.jpg)
![En el caso de un sistema químico en el que todas las concentraciones
de las distintas sustancias participantes permanecen constantes, excepto
una (por ejemplo A), la FEM será función de A solamente; es decir que la
ecuación de Nernst se transforma en :
Aspectos cuantitativos para
potenciometrías directas
0,059
E = Eo - ——— log [Aª]
. n
Medida del pH
Por definición pH = -log [H+
] o más propiamente pH=-log aH
. (aH : actividad del
hidrógeno)](https://image.slidesharecdn.com/electroanlisis-130605171314-phpapp01/85/Electroanalisis-21-320.jpg)
![La ecuación de Nernst queda :
E = E ref - 0,059 log aH
(Eref : potencial del electrodo de referencia con respecto al del
hidrógeno)
El pH de una disolución neutra corresponde a aquella donde [H+
] es
igual a la del agua pura, cuya constante Kw= [H+
].[OH-
]= 1 x 10-14
; es
decir que el pH= 7 en este caso.
Relación entre pH y temperatura
El pH varía sensiblemente con la temperatura, por lo que la expresión de
Nernst se modifica en la siguiente forma:
0,059
E = Eref + ——— T. pH = E ref + 0,0001984. T. pH
298](https://image.slidesharecdn.com/electroanlisis-130605171314-phpapp01/85/Electroanalisis-22-320.jpg)













