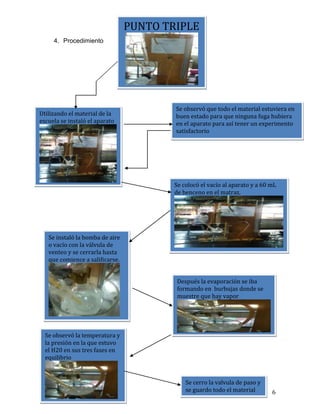
Este documento describe un experimento realizado por un equipo de estudiantes para determinar las condiciones de presión y temperatura del punto triple del benceno. El procedimiento involucró la instalación de un aparato de vacío con benceno y la observación de sus tres estados de agregación a medida que se reducía la presión y temperatura. Los resultados experimentales se compararon con los valores teóricos, encontrando una desviación mayor en la presión que en la temperatura. El equipo concluyó que lograron observar el punto triple pero que se necesita un equip