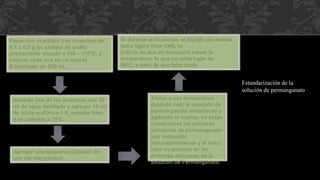
Este documento describe un experimento de permanganimetría para preparar y estandarizar una solución de permanganato de potasio 0.1N. Se explican los conceptos de oxidación-reducción y el uso del permanganato como agente oxidante. El procedimiento incluye pesar permanganato de potasio, disolverlo en agua, y estandarizar la solución mediante la titulación de muestras de oxalato de sodio usando cálculos de normalidad.