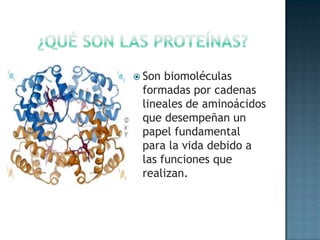
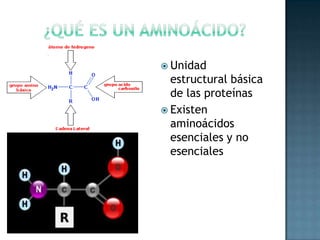
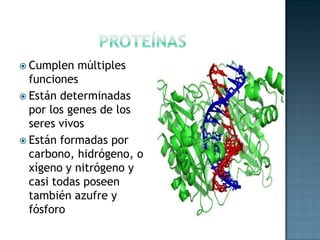
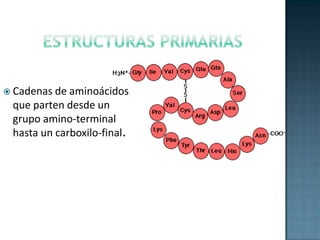
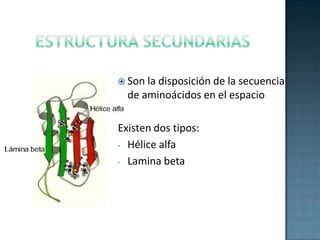
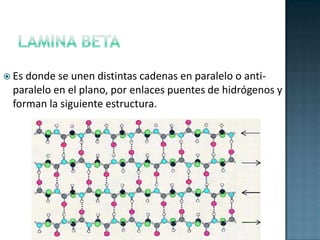
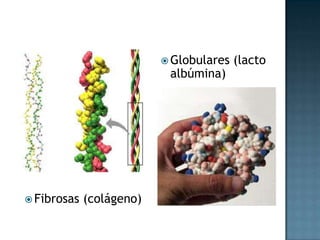
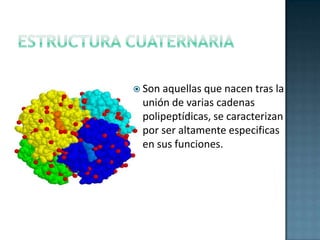
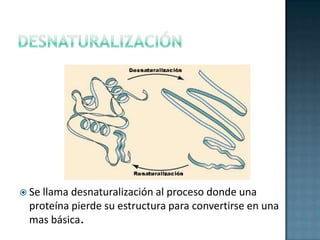
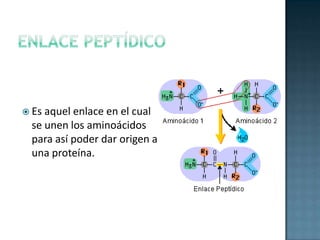
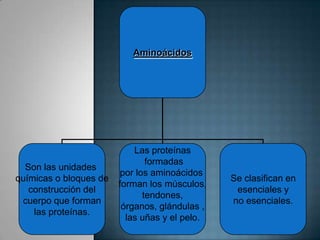
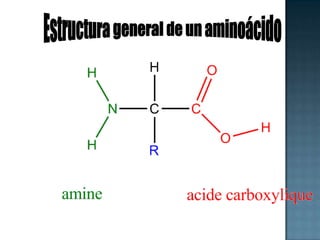
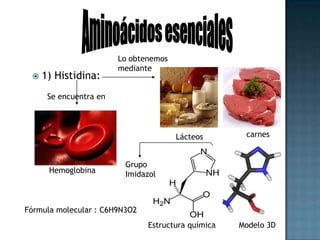
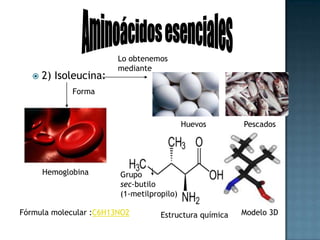
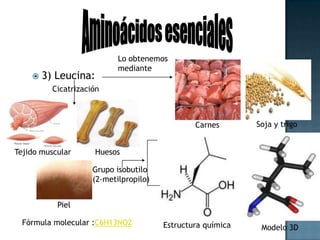
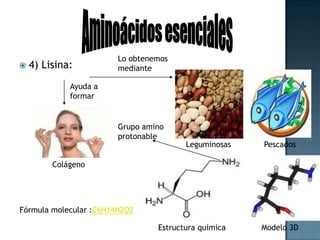
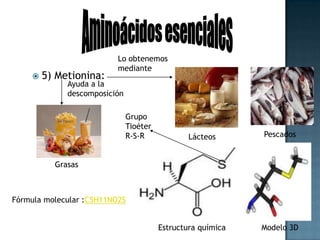
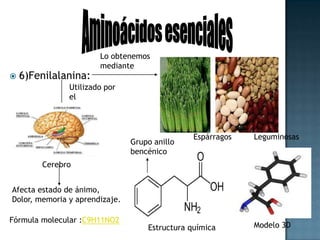
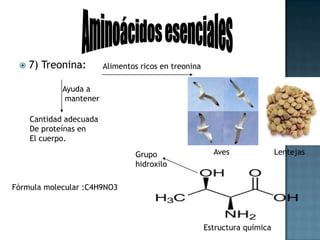
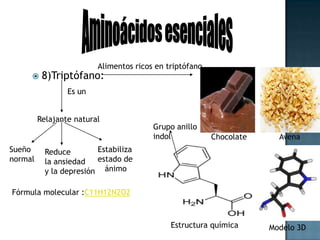
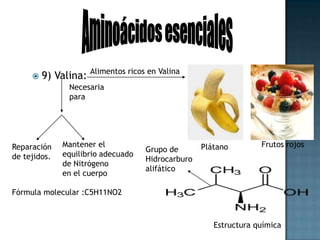
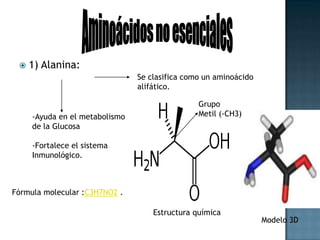
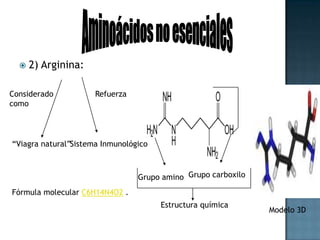
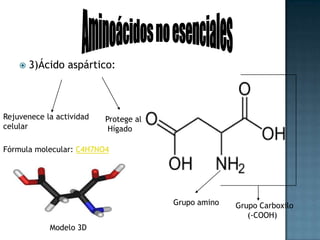
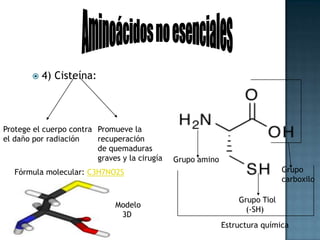
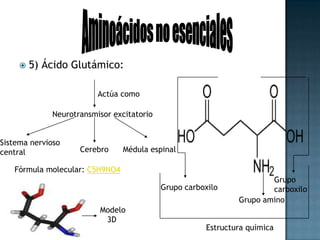
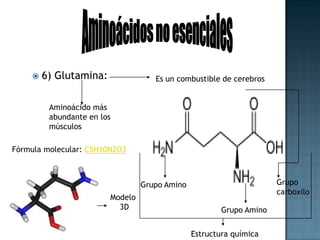
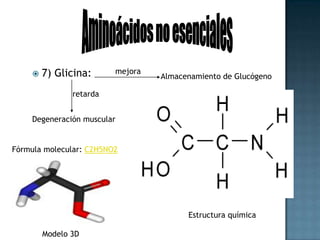
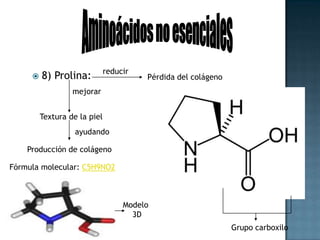
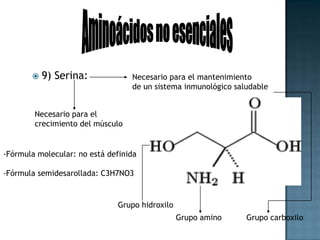
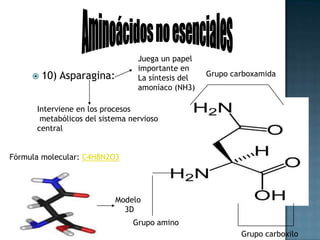
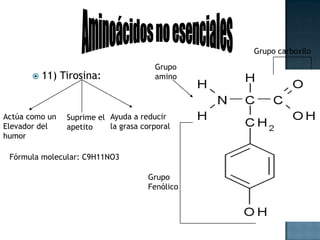
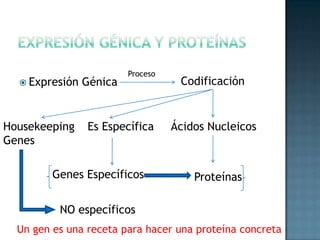
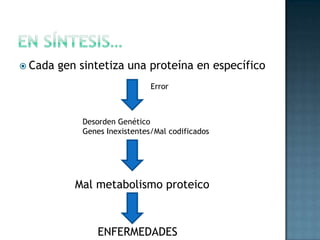
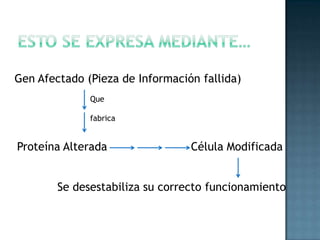
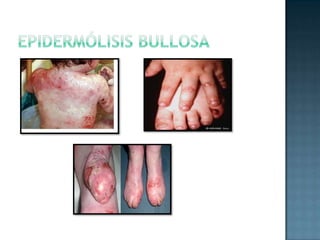
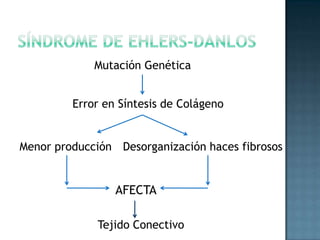
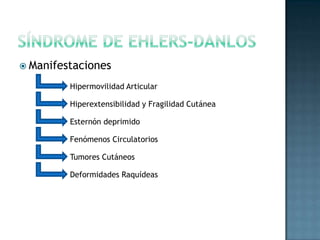
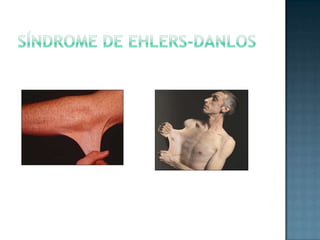
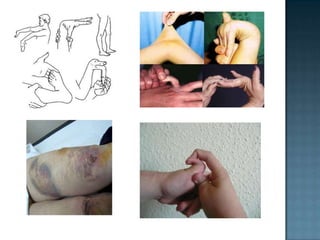
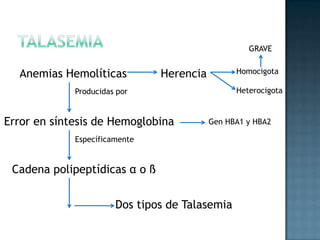
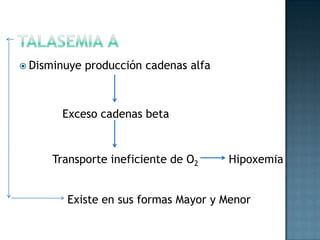
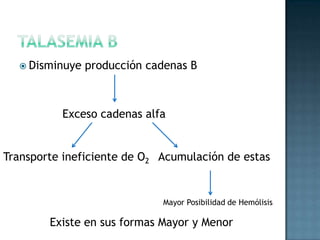
Las proteínas son biomoléculas formadas por aminoácidos que cumplen funciones esenciales. Se organizan en estructuras primarias, secundarias, terciarias y cuaternarias. Los aminoácidos se unen mediante enlaces peptídicos para formar péptidos y proteínas. Existen aminoácidos esenciales y no esenciales. Las proteínas están determinadas por los genes y errores en su síntesis pueden causar enfermedades.