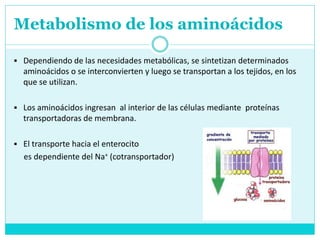
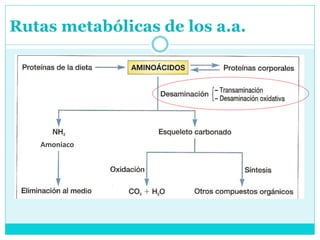
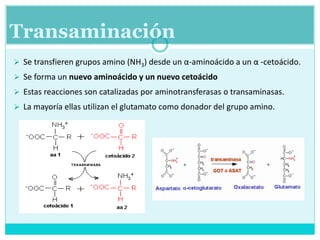
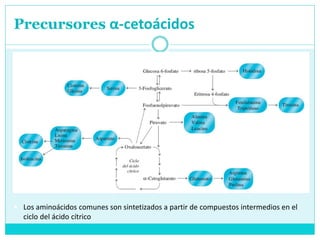
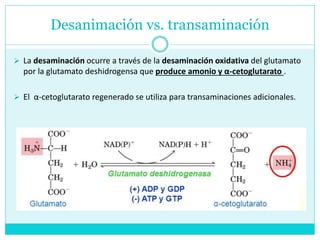
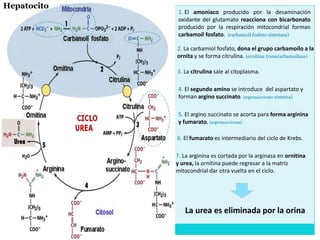
Este documento describe el metabolismo de los aminoácidos en los mamíferos. Explica que los mamíferos pueden sintetizar aminoácidos no esenciales pero deben obtener los esenciales de los alimentos. Describe las rutas metabólicas de la transaminación y desaminación oxidativa, y cómo la desaminación produce amoníaco que luego se convierte en urea a través del ciclo de la urea en el hígado para su excreción.