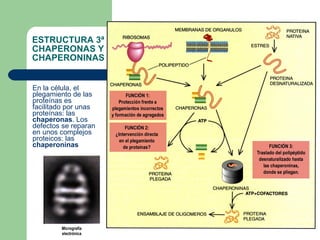
El documento describe los diferentes niveles estructurales de las proteínas, incluyendo la estructura primaria, secundaria, terciaria y cuaternaria. Explica cómo la duplicación de genes puede dar lugar a proteínas similares como la hemoglobina y la mioglobina. También describe factores que pueden desnaturalizar proteínas como la temperatura, pH y fuerza iónica. Finalmente, discute priones y cómo ciertas proteínas pueden plegarse de manera anormal transmitiendo ese plegamiento a otras proteínas.