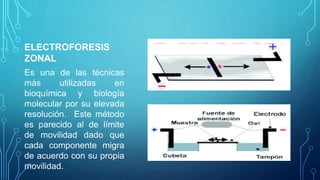
Este documento proporciona una introducción a la electroforesis. Define la electroforesis como la migración de solutos iónicos bajo la influencia de un campo eléctrico. Explica que las partículas migran hacia el cátodo o ánodo dependiendo de su carga, peso molecular y estructura. También resume los diferentes tipos de electroforesis como la electroforesis de límite móvil, zonal e isoelectroenfoque. Además, describe los diferentes medios de electroforesis como el papel, gel, capilar y otros. Finalmente, ident