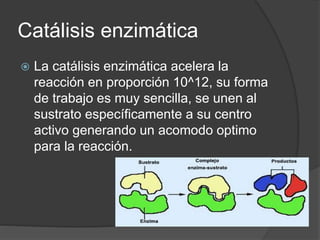
La catálisis enzimática acelera las reacciones químicas en proporciones de hasta 10^12. Las enzimas catalizan las reacciones a través de mecanismos como la catálisis covalente, la catálisis ácido-base y la fijación preferencial del estado de transición. Estos mecanismos involucran la unión del sustrato al centro activo de la enzima para aproximar y orientar los grupos reactivos y estabilizar cargas durante la reacción.













































![Bibliografia
[1]Koolman, Jan; Röhm, Klaus-Heinrich.
Bioquímica: Texto y atlas. 3aedición. Editorial
Médica Panamericana; 2004. P.90
[2] harper
[3] Berg, Jeremy; Tymococzko, John; Stryer,
Lubert. Bioquímica. 2ª edición. Editorial
Reverté;2008. P. 242
[4] Melo V, Cuamatzi O. Bioquímica de los
procesos metabólicos. España: Reverté;
2007.p.360.
[5] Voet, Donald; Voet G., Judith. Bioquímica. 3ª
edición. Editorial Médica Panamericana; 2006. P.
518-519](https://image.slidesharecdn.com/tiposdecatalisis-150131213357-conversion-gate02/85/Tipos-de-catalisis-47-320.jpg)