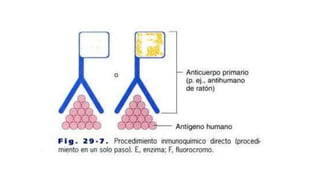
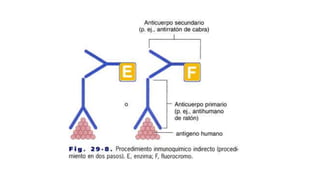
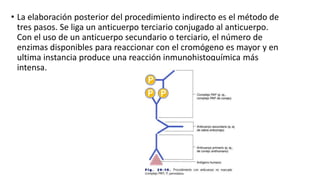
Este documento describe la técnica de inmunohistoquímica (IHQ), incluyendo su definición, métodos directos e indirectos, preparación de muestras, utilización e importancia. También presenta un caso clínico donde se utilizó IHQ para identificar fimbrias de E. coli en cerdos lactantes con diarrea.