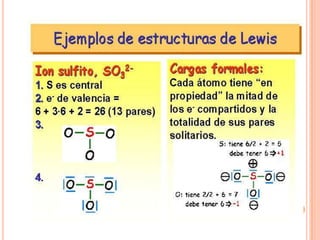
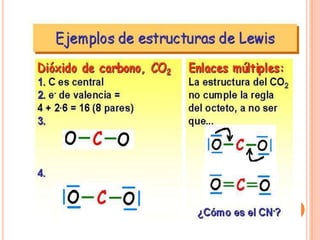
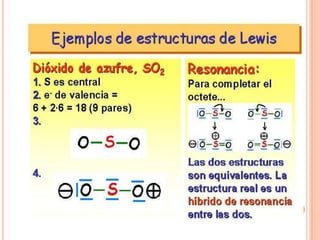
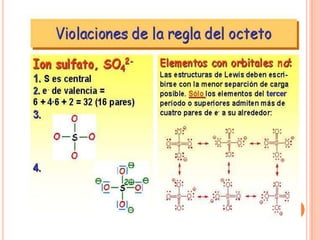
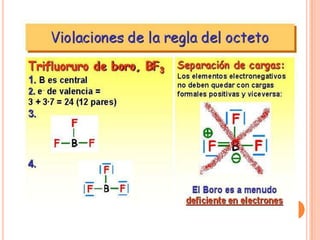
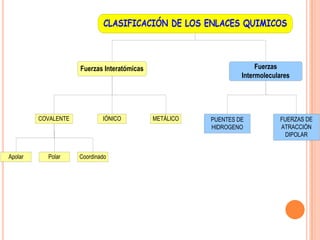
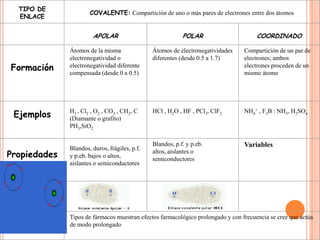
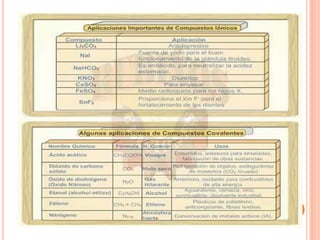
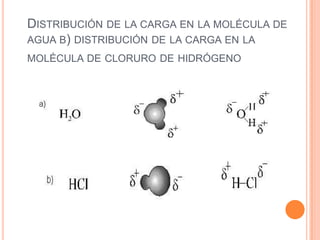
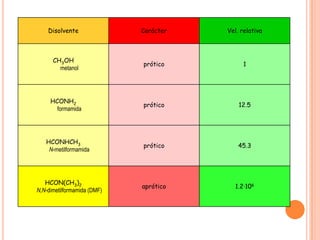
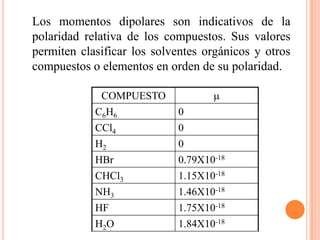
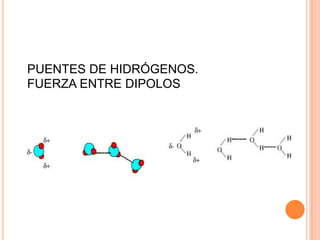
El documento describe la evolución histórica de la teoría estructural de la química orgánica desde las primeras observaciones e hipótesis en el siglo XIX hasta la teoría cuántica en el siglo XX. Explica conceptos clave como la valencia, la notación de Lewis, los diferentes tipos de enlaces, la estructura molecular y la polaridad. Finalmente, analiza cómo la polaridad afecta la solubilidad de compuestos orgánicos.