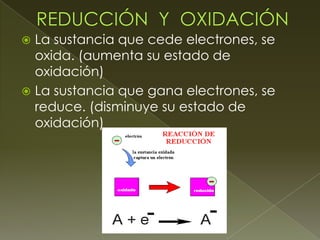
Este documento trata sobre las reacciones de óxido-reducción y los estados de oxidación. Explica que estas reacciones implican la transferencia de electrones entre especies químicas y que los estados de oxidación permiten determinar qué ocurre con los electrones asignando cargas a los átomos. También presenta reglas para asignar estados de oxidación y resuelve ejemplos aplicando estas reglas.