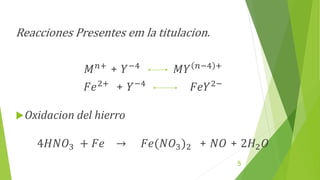
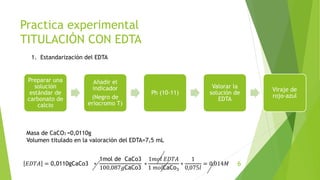
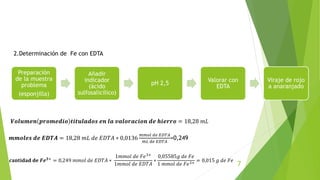
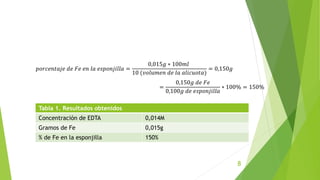
Este documento describe un procedimiento experimental para determinar el porcentaje de hierro en una muestra mediante titulación complejométrica con EDTA. Se estandariza una solución de EDTA usando carbonato de calcio y un indicador. Luego se titula la muestra de hierro usando ácido sulfosalicílico como indicador. El porcentaje de hierro en la muestra se calcula a partir del volumen de EDTA usado y las equivalencias de las reacciones. El resultado obtenido fue un 150% de hierro en la muestra.