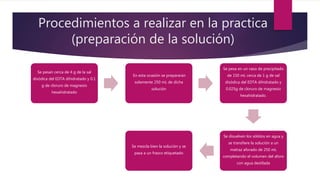
La práctica determina la dureza del agua mediante titulaciones complejométricas con EDTA, un agente quelante que forma complejos solubles con iones metálicos. Se estandariza una solución de calcio y se titula con EDTA usando el indicador Eriocromo T Negro. Los cálculos muestran que la concentración de la solución de EDTA es de 0.009 M.