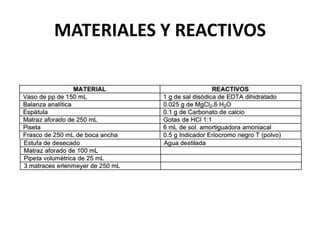
Este documento describe los procedimientos para preparar y estandarizar una solución de EDTA 0.01 M que se usará para determinar la dureza del agua mediante titulación complejométrica. Explica que el EDTA forma complejos solubles con iones metálicos y que al ajustar el pH se puede lograr selectividad. Luego detalla los pasos para pesar y disolver los reactivos necesarios, transferir la solución a un matraz aforado y estandarizarla mediante titulaciones repetidas.