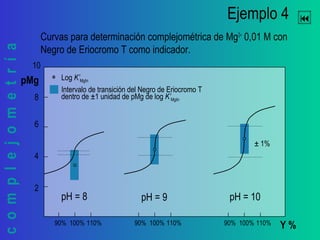
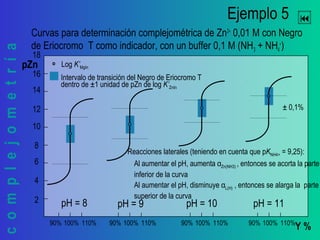
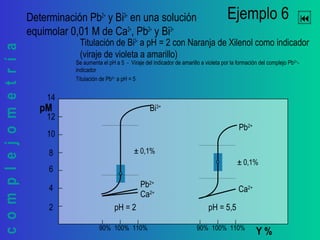
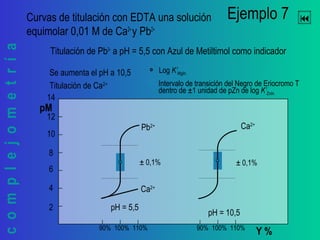
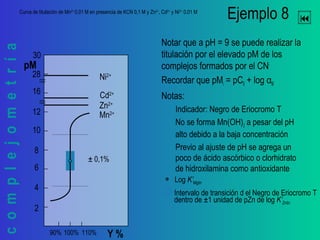
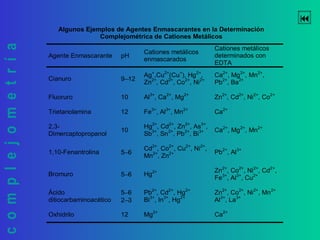
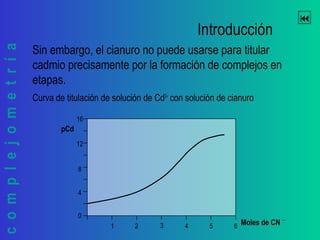
Este documento trata sobre la complejometría. Explica las curvas de titulación, cómo construirlas y calcular el punto de equivalencia. Incluye ejemplos de curvas de titulación para determinar calcio y cinc con EDTA usando indicadores metalocrómicos como el negro de eriocromo T.


![complejometría
Introducción
Agente más común: EDTA
Antes de la introducción del EDTA todas las
técnicas estaban limitadas a la utilización de,
p. ej.: -
CN
CNCd -2
++
[ ]+
CdCN
[ ] CNCdCN -
+
+
( )[ ]2CNCd
( )[ ] CNCNCd -
2 + ( )[ ]-
3CNCd
( )[ ] CNCNCd -
+
−
( )[ ] -2
4CNCd
CNCd -2
++
( )[ ] -2
4CNCd
log k1=5,5
log k2=5,1
log k3=4,7
log k4=3,6
log β4=18,9](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-3-320.jpg)

![complejometría Curva de Titulación (Método Analítico)
Antes del Punto de Equivalencia (0 < f < 1)
[ML]]L[
VV
VC
0
1
+′=
+
⋅
[ML]]M[
VV
VC
0
00
+′=
+
⋅
MLV),(CL)V,(CM 100 ←→↓+
Balances de Masa
VV
VCVC
]M[
0
100
+
⋅−⋅
=′
00
0
00
1
00
00
VC
VV
VC
VC
VC
VC
]M[
⋅
+
⋅
⋅
−
⋅
⋅
=′
⋅
⋅
−⋅
+
⋅=′
00
1
0
0
0
VC
VC
1
VV
V
C]M[ f)(1
VV
V
C]M[
0
0
0 −⋅
+
⋅=′ f)(1
VV
V
α
C
[M]
0
0
M
0
−⋅
+
⋅= f)(1
CfC
C
α
C
[M]
01
1
M
0
−⋅
⋅+
⋅=
=
+
⋅
VV
VC
0
00
=
+
⋅
VV
VC
0
1](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-6-320.jpg)
![complejometría Curva de Titulación (Método Analítico)
En el Punto de Equivalencia (f = 1)
[ML]]L[
VV
VC
0
1
+′=
+
⋅
[ML]]M[
VV
VC
0
00
+′=
+
⋅
MLV),(CL)V,(CM 100 ←→↓+
Balances de Masa
[ML]]L[[ML]]M[VCVC eq100 +′=+′⇒⋅=⋅
L
M
α
α[M]
[L]]L[]M[
⋅
=⇒′=′
+
⋅
⋅
⋅⋅
=
⋅
=
eq0
00
L
M
i
VV
VC
α
[M]α[M]
[ML]
[L][M]
k
eq0
0
M
0Li
VV
V
α
Cαk
[M]
+
⋅
⋅⋅
=
)C(Cα
CCαk
[M]
01M
10Li
+⋅
⋅⋅⋅
=
eq eq
eq](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-7-320.jpg)
![complejometría Curva de Titulación (Método Analítico)
Después del Punto de Equivalencia (f > 1)
[ML]]L[
VV
VC
0
1
+′=
+
⋅
[ML]]M[
VV
VC
0
00
+′=
+
⋅
MLV),(CL)V,(CM 100 ←→↓+
Balances de Masa
VV
VCVC
]L[
0
001
+
⋅−⋅
=′
−
⋅
⋅
⋅
+
⋅
=
⋅
+
⋅
⋅
−
⋅
⋅
=′ 1
VC
VC
VV
VC
VC
VV
VC
VC
VC
VC
]L[
00
1
0
00
00
0
00
00
00
1
1)(f
VV
VC
]L[
0
00
−⋅
+
⋅
=′ 1)(f
V)(Vα
VC
[L]
0L
00
−⋅
+⋅
⋅
=
1)(f
α
[M]
VV
VC
1)(f
V)(Vα
VC
[M]
[ML]
[L][M]
k
L
0
00
0L
00
i −⋅=
+
⋅
−⋅
+⋅
⋅
⋅
=
⋅
=
1)(f
αk
[M] Li
−
⋅
=](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-8-320.jpg)


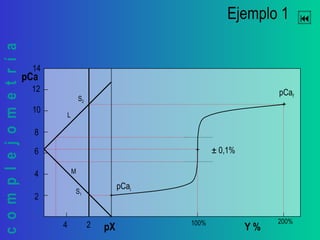
![complejometría
pM vs. Y %
Y %
2
16
14
12
10
8
6
4
pM
pX4 2
Construcción de la curva de titulación
pki =
log kf
Y % = % titulado respecto del punto de equivalencia
pX = - log [X] X = M’ ó L’ según la recta de que se trate
pM = - log [M] contenido total de cationes libres, no complejados.](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-11-320.jpg)
![complejometría
Y %
2
16
14
12
10
8
6
4
pM
pX4 2
pki
pM = pC0 + log αM
Construcción de la curva de titulación
S1
M ’
S1 - punto de pM inicial (Y % = 0 %)
log αM
pC0
pMi
pM’ = pC0 M’= contenido total de cationes considerando todas las especies
M
M
αlogMppM
α
]M[
[M] +′=⇒
′
=](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-12-320.jpg)
![complejometría Construcción de la curva de titulación
Y %
2
16
14
12
10
8
6
4
pM
pX4 2
pki
S1
M ’
log αM
pC0
pMi
L’
S2 pMf
100% 200%
log αL
pM = pki - log αL
S2 - punto de pM final (Y % = 200 %)
pL’ = pC0 L’= contenido total de ligando considerando todas las especies
[L]
[ML]k
[M] i ⋅
=
]L[
α[ML]k
[M] Li
′
⋅⋅
=
Después del PE [ML] ≅ C0
]L[
αCk
[M] L0i
′
⋅⋅
= L0i αlogpCpkLppM −++′−=](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-13-320.jpg)
![complejometría Construcción de la curva de titulación
Otros puntos de la curva
Y %
2
16
14
12
10
8
6
4
pM
pX4 2
S1
M ’
log αM
pC0
L’
S2
100% 200%
log αL
pki
[ML]]L[
VV
VC
[ML]]M[
VV
VC
0
1
0
00
+′=
+
⋅
+′=
+
⋅
≅ 0
≅ 0
[ML]]L[
V
VC
[ML]]M[C
0
1
0
+′=
⋅
+′=
( )f1C
VC
VC
1C]M[ 0
00
1
0 −⋅=
⋅
⋅
−⋅=′ [ML]]L[[ML]]M[
V
VC
C
0
eq1
0 +′=+′⇒
⋅
=
eq
( )1fC1
VC
VC
C]L[ 0
00
1
0 −⋅=
−
⋅
⋅
⋅=′
Antes del Punto de Equivalencia
En el Punto de Equivalencia
Después del Punto de Equivalencia
[M’] = C0·(1 - f)
[L’] = C0·(f - 1)
[M’] = [L’]](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-14-320.jpg)
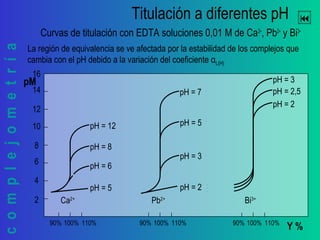
![complejometría
Y %
2
16
14
12
10
8
6
4
pM
pX4 2
S1
M ’
log αM
pC0
L’
S2
100% 200%
log αL
Construcción de la curva de titulación
Otros puntos de la curva
90%99%99,9%100,1%
± 0,1% pki
Antes del Punto de Equivalencia
En el Punto de Equivalencia
Después del Punto de Equivalencia
101%110%
[L’] = C0·(f - 1)
[M’] = C0·(1 - f)
[M’] = [L’]
[M’] = C0·(1 - f)[M’] = C0·(1 - f)
[M’] = [L’][M’] = [L’]
[L’] = C0·(f - 1)[L’] = C0·(f - 1)](https://image.slidesharecdn.com/titulacionescomplejomtricas-130523094459-phpapp02/85/Titulaciones-complejometricas-15-320.jpg)