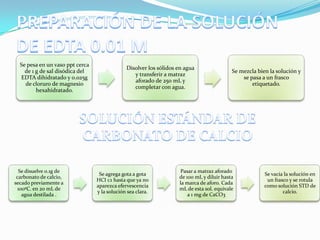
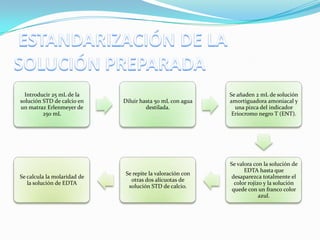
El documento describe la formación y estabilidad de complejos en la determinación de la dureza del agua. Explica que las titulaciones complejométricas determinan iones metálicos mediante la reacción con un agente complejante como el EDTA. El EDTA es un ligando hexadentado que forma complejos fuertes con cationes metálicos y se usa comúnmente en titulaciones complejométricas.