Manual qoii (1411) 2012 02
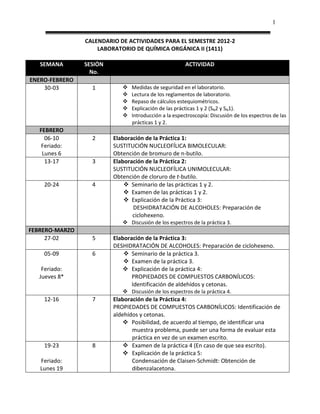
- 1. 1 CALENDARIO DE ACTIVIDADES PARA EL SEMESTRE 2012-2 LABORATORIO DE QUÍMICA ORGÁNICA II (1411) SEMANA SESIÓN ACTIVIDAD No. ENERO-FEBRERO 30-03 1 Medidas de seguridad en el laboratorio. Lectura de los reglamentos de laboratorio. Repaso de cálculos estequiométricos. Explicación de las prácticas 1 y 2 (SN2 y SN1). Introducción a la espectroscopía: Discusión de los espectros de las prácticas 1 y 2. FEBRERO 06-10 2 Elaboración de la Práctica 1: Feriado: SUSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR: Lunes 6 Obtención de bromuro de n-butilo. 13-17 3 Elaboración de la Práctica 2: SUSTITUCIÓN NUCLEOFÍLICA UNIMOLECULAR: Obtención de cloruro de t-butilo. 20-24 4 Seminario de las prácticas 1 y 2. Examen de las prácticas 1 y 2. Explicación de la Práctica 3: DESHIDRATACIÓN DE ALCOHOLES: Preparación de ciclohexeno. Discusión de los espectros de la práctica 3. FEBRERO-MARZO 27-02 5 Elaboración de la Práctica 3: DESHIDRATACIÓN DE ALCOHOLES: Preparación de ciclohexeno. 05-09 6 Seminario de la práctica 3. Examen de la práctica 3. Feriado: Explicación de la práctica 4: Jueves 8* PROPIEDADES DE COMPUESTOS CARBONÍLICOS: Identificación de aldehídos y cetonas. Discusión de los espectros de la práctica 4. 12-16 7 Elaboración de la Práctica 4: PROPIEDADES DE COMPUESTOS CARBONÍLICOS: Identificación de aldehídos y cetonas. Posibilidad, de acuerdo al tiempo, de identificar una muestra problema, puede ser una forma de evaluar esta práctica en vez de un examen escrito. 19-23 8 Examen de la práctica 4 (En caso de que sea escrito). Explicación de la práctica 5: Feriado: Condensación de Claisen-Schmidt: Obtención de Lunes 19 dibenzalacetona.
- 2. 2 SEMANA SESIÓN ACTIVIDAD No. ABRIL Discusión de los espectros de la práctica 5. Elaboración de la Práctica 5. 26-30 9 Explicación de la práctica 6: Obtención del ácido acetilsalicílico por medio de un proceso de química verde. Discusión de los espectros de la práctica 6. Elaboración de la Práctica 6. Examen de la Práctica 5. 02-06 SEMANA SANTA 09-13 10 Explicación de la práctica 7. Discusión de los espectros de la práctica 7. Elaboración de la práctica 7: SUSTITUCIÓN ELECTROFÍLICA AROMÁTICA: Nitración de benzoato de metilo: Obtención de 3- nitrobenzoato de metilo. 16-20 11 Examen de las Prácticas 6 y 7. Explicación de la práctica 8: SUSTITUCIÓN NUCLEOFÍLICA AROMÁTICA: a) Obtención de 2,4-dinitrofenilhidrazina. b) Obtención de 2,4-dinitrofenilanilina. Discusión de los espectros de la práctica 8. 23-27 12 Elaboración de la Práctica 8: SUSTITUCIÓN NUCLEOFÍLICA AROMÁTICA: a) Obtención de 2,4-dinitrofenilhidrazina. b) Obtención de 2,4-dinitrofenilanilina. Discusión de la práctica 8. Examen de la práctica 8. ABRIL-MAYO 30-04 13 Explicación de la Práctica de reposición: OXIDACIÓN DE ALCOHOLES: Oxidación de n-butanol a n- butiraldehído. Elaboración de la práctica de reposición. Evaluación de la Práctica de reposición de acuerdo al criterio del profesor. 07-11 ENTREGA DE CALIFICACIONES A LOS ALUMNOS Y A LA SECCIÓN 14-18 ENTREGA DE CALIFICACIONES A LOS PROFESORES DE TEORÍA 25 FIN DE CURSOS
- 3. 3 SUSPENSIONES: Lunes 6 de febrero, Jueves 8 de marzo*, Lunes 19 de marzo. * Suspensión únicamente para el personal administrativo. CIUDAD UNIVERSITARIA, D.F., 19 DE ENERO DE 2011 PROFRA. G. YAZMÍN ARELLANO SALAZAR JEFE DE LABORATORIO
- 4. 4 TALLER DE ESPECTROSCOPÍA I. OBJETIVOS a) Conocer los principios fundamentales que rigen la interacción energía- materia (radiación electromagnética-moléculas) en uno de los métodos espectroscópicos más comunes en Química Orgánica: Infrarrojo (IR) b) Comprender la información contenida en los espectros correspondientes, a fin de identificar los grupos funcionales más comunes. c) Manejar las tablas de absorción correspondientes con el fin de resolver ejemplos sencillos de elucidación estructural de algunos compuestos orgánicos. II. MATERIAL Colección de espectros de infrarrojo. III. INFORMACIÓN La espectroscopía es el estudio de la interacción de la radiación con la materia. La radiación electromagnética es una amplia gama de diferentes contenidos energéticos y comprende valores que van desde los rayos 14 -6 cósmicos (10 cal/mol) hasta la radiofrecuencia (10 cal/mol). Toda onda electromagnética está constituida por una onda eléctrica y una onda magnética. Cada onda electromagnética posee un valor de energía (E), así como de frecuencia ( ), longitud de onda ( ) y un número de onda ( ); que se relacionan entre sí a través de las siguientes expresiones: -1 E=h =c / E = h (c / ) =1 / (en cm ) Por otro lado, la energía total de un sistema molecular está dada por:
- 5. 5 ET = Etrans + Erot + Evibr + Eelectr Donde: Etrans = Energía de translación, que es la energía cinética que posee una molécula debido a su movimiento de translación en el espacio. Erot = Energía de rotación, que es la energía cinética que posee debido a la rotación alrededor de sus ejes que convergen en su centro de masa. Evibr = Energía de vibración, que es la energía potencial y la energía cinética que posee debido al movimiento vibracional de sus enlaces. Eelectr = Energía electrónica, que es la energía potencial y energía cinética de sus electrones. ESPECTROSCOPÍA DE INFRARROJO Es una técnica analítica instrumental que permite conocer los principales grupos funcionales de la estructura molecular de un compuesto. Esta información se obtiene a partir del espectro de absorción de dicho compuesto al haberlo sometido a la acción de la radiación infrarroja en un espectrofotómetro. La región del espectro IR normal queda comprendida entre 2.5 m a 15 m, medido en unidades de longitud de onda, que corresponde a 4,000 -1 -1 cm y 666 cm respectivamente si se expresa en número de onda (que es -1 el inverso de la longitud de onda, cm ). CARACTERÍSTICAS DE UN ESPECTRO El espectro de infrarrojo de un compuesto es una representación -1 gráfica de los valores de onda ( m) o de frecuencia (cm ) contra los valores de por ciento de transmitancia (%T). La absorción de radiación IR por un compuesto a una longitud de onda dada, origina un descenso en el %T, lo que se pone de manifiesto en el espectro en forma de un pico o banda de absorción.
- 6. 6 100.0 90 80 70 60 50 %T 40 30 20 10 3.9 4000.0 3000 2000 1500 1000 605.0 cm-1 Figura 1 VIBRACIÓN MOLECULAR Las moléculas poseen movimiento vibracional continuo. Las vibraciones suceden a valores cuantizados de energía. Las frecuencias de vibración de los diferentes enlaces en una molécula dependen de la masa de los átomos involucrados y de la fuerza de unión entre ellos. En términos generales, las vibraciones pueden ser de dos tipos: estiramiento (stretching) y flexión (bending). Las vibraciones de estiramiento son aquéllas en las que los átomos de un enlace oscilan alargando y acortando la distancia del mismo sin modificar el eje ni el ángulo de enlace. VIBRACIONES DE ESTIRAMIENTO O TENSIÓN
- 7. 7 Figura 2 Las vibraciones de flexión son aquellas que modifican continuamente el ángulo de enlace. VIBRACIONES DE FLEXIÓN Tijera: Vibraciones de deformación en el plano Sacudida: Vibraciones de deformación en el plano Balanceo: Vibraciones de deformación fuera del plano
- 8. 8 Torsión: Vibraciones de deformación fuera del plano Nota: + y - se refieren a vibraciones perpendiculares al plano del papel. Figura 3
- 9. 9 ABSORCIÓN DE ENERGÍA Para que sea posible la absorción de la energía infrarroja por parte de una sustancia, es necesario que la energía que incide sobre ella sea del mismo valor que la energía de vibración que poseen las moléculas de esa sustancia. Ya que en una molécula existen diferentes átomos que forman distintos enlaces, en el espectro de infrarrojo aparecerán bandas de absorción a distintos valores de frecuencia y de longitud de onda. La región situada entre -1 1,400 y 4,000 cm , es de especial utilidad para la identificación de la mayoría de los grupos funcionales presentes en las moléculas orgánicas. Las absorciones que aparecen en esta zona, proceden fundamentalmente de las vibraciones de estiramiento. -1 La zona situada a la derecha de 1,400 cm es, por lo general, compleja, debido a que en ella aparecen vibraciones tanto de estiramiento como de flexión. Cada compuesto tiene una absorción característica en esta región, esta parte del especto se denomina como la región de las huellas dactilares. ABSORCIONES DE GRUPOS FUNCIONALES EN EL IR HIDROCARBUROS La absorción por estiramiento (stretching) carbono-hidrógeno (C-H), está relacionada con la hibridación del carbono. Csp3 ______ H (-CH, alcanos): 2,800-3,000 cm -1 Csp2 ______ H (=CH, alquenos): 3,000-3,300 cm -1 Csp2 ______ H (=CH, aromático): 3,030 cm -1 -1 Csp ______ H (=CH, alquinos): 3,300 cm Tabla 1
- 10. 10 ALCANOS -1 C-H Vibración de estiramiento 3,000 cm -1 a) En alcanos la absorción ocurre a la derecha de 3,000 cm . b) Si un compuesto tiene hidrógenos vinílicos, aromáticos o -1 acetilénicos, la absorción del –CH es a la izquierda de 3,000 cm . -1 -CH2 Los metilenos tienen una absorción característica de 1,450-1,485 cm -1 (flexión). La banda de 720 cm se presenta cuando hay más de 4 metilenos juntos. -1 -CH3 Los metilos tienen una absorción característica de 1,375-1,380 cm . -1 La banda de 1,380 cm , característica de metilos se dobletea cuando hay isopropilos o ter-butilos, apareciendo también las siguientes señales: Tabla 2 H 3C -1 -1 1,380 doblete 1,170 cm 1,145 cm CH H3C CH3 -1 -1 1,380 doblete 1,255 cm 1,210 cm H3C C CH3 Tabla 3
- 11. 11 Figura 4 Espectro del heptano mostrando las vibraciones de tensión
- 12. 12 ALQUENOS -1 =C-H Vibración de estiramiento (stretching), ocurre a 3,000-3,300 cm . C=C Vibración de estiramiento (stretching), en la región de 1,600-1,675 -1 cm , a menudo son bandas débiles. =C-H Vibración de flexión (bending) fuera del plano en la región de -1 1,000-650 cm . Tabla 4 Figura 5 Espectro del 1-octeno
- 13. 13 ALQUINOS -1 C-H Vibración de estiramiento ocurre a 3,300 cm . -1 C C Vibración de estiramiento cerca de 2,150 cm . La conjugación desplaza el alargamiento C-C a la derecha. Tabla 5 Figura 6 Espectro del 1-decino
- 14. 14 AROMÁTICOS -1 =C-H La absorción por estiramiento es a la izquierda de 3,000 cm . -1 C-H Flexión fuera del plano en la región de 690-900 cm , este tipo de absorción permite determinar el tipo de sustitución en el anillo. Ver tabla. -1 C=C Existen absorciones que ocurren en pares a 1,600 cm y 1,450 cm-1 y son características del anillo aromático. Tabla 6 Figura 8
- 15. 15 Flexión C-H Fuera del plano en la región 690-900 cm-1 cm-1 cm-1 Monosustitución 770-730 1,3,5-Trisustitución 840 710-690 1,2,4-Trisustitución 825-805 1,2- 770-735 885-870 Disustitución 1,2,3,4- 810-800 1,3- 710-690 Tetrasustitución Disustitución 810-750 1,2,4,5- 870-855 Tetrasustitución 1,4- 840-810 1,2,3,5- 850-840 Disustitución Tetrasustitución 1,2,3- 780-760 Pentasustitución 870 Trisustitución 745-705 Tabla 7 Figura 9 Espectro del tolueno
- 16. 16 ALCOHOLES -OH Vibración de estiramiento. Para un alcohol asociado la característica es una banda intensa y -1 ancha en la región de 3,000-3,700 cm . -1 Un alcohol monomérico da una banda aguda en 3610-3640 cm . -1 C-O Vibración de estiramiento localizada en 1,000-1,200 cm . -1 C-OH Flexión en el plano en 1,200-1,500 cm . -1 C-OH Flexión fuera del plano en 250-650 cm . Tabla 8 Figura 10 Espectro del alcohol sec-butílico
- 17. 17 AMINAS -1 N-H Bandas de estiramiento en la zona de 3,300-3,500 cm . Las aminas primarias presentan dos bandas. Las aminas secundarias presentan una banda, a menudo débil. Las aminas terciarias no presentan banda de estiramiento N-H. C-N La banda de alargamiento es débil y se observa en la zona de 1,000- -1 1,350 cm . -1 N-H Banda de flexión (tijera) se observa en la zona de 1,640-1,560 cm , banda ancha. - N-H Banda de flexión fuera del plano, se observa en la zona de 650-900 cm 1 . Tabla 9 Figura 11 Espectro de la sec-butilamina
- 18. 18 COMPUESTOS CARBONÍLICOS Los aldehídos, las cetonas, los ácidos carboxílicos y sus derivados, dan la banda del carbonilo, este grupo es uno de los que absorben con una -1 alta intensidad en la región del infrarrojo en la zona de 1,850-1,650 cm . Posición de la absorción: -1 Grupo funcional cm m Aldehído RCHO 1,720-1,740 5.75-5.80 Cetona RCOR 1,705-1,750 5.70-5.87 Ácido Carboxílico RCOOH 1,700-1,725 5.80-5.88 Éster RCOOR 1,735-1,750 5.71-5.76 R= grupo saturado y alifático Vibraciones de estiramiento de compuestos carbonílicos Tabla 10 ALDEHÍDOS -1 C=O Banda de estiramiento en 1,725 cm . La conjugación con dobles enlaces mueve la absorción a la derecha. -1 C-H Banda de estiramiento del hidrógeno aldehídico en 2,750 cm y -1 2,850 cm . Tabla 11 Figura 12 Espectro del n-butiraldehído
- 19. 19 CETONAS -1 C=O Banda de alargamiento aproximadamente a 1,715 cm . La conjugación mueve la absorción a la derecha. Tabla 12 Figura 13 Espectro de la 2-butanona
- 20. 20 ÁCIDOS O-H Banda de estiramiento, generalmente muy ancha (debido a la -1 asociación por puente de hidrógeno) en la zona de 3,000-2,500 cm , a menudo interfiere con la absorción del C-H. -1 C=O Banda de estiramiento ancha en la zona de 1,730-1,700 cm . -1 C-O Banda de estiramiento fuerte en la zona de 1,320-1,210 cm . Tabla 13 Figura 14 Espectro del ácido propiónico
- 21. 21 ÉSTERES -1 C=O Banda de estiramiento cercana a 1,735 cm . C-O Banda de estiramiento, aparecen 2 bandas o más, una más fuerte -1 que las otras, en la zona de 1,300-1,000 cm . Tabla 14 E Figura 15 Espectro del acetato de metilo IV. PROCEDIMIENTO En la serie de espectros de infrarrojo que se presentan al final de cada práctica señale las bandas de absorción características que le darán la pauta para identificar un compuesto, señale además el tipo de vibración que corresponde a la banda.
- 22. 22 V. ANTECEDENTES 1) Estructura molecular de alcanos, alquenos, alquinos, compuestos aromáticos, alcoholes, aldehídos, cetonas, aminas, ácidos carboxílicos y ésteres. VI. CUESTIONARIO 1) ¿Cuáles son las principales bandas de absorción para un alcano en un espectro de IR? 2) ¿Cómo distingue un grupo isopropilo de un grupo ter-butilo en un espectro de IR? 3) Cuando un alcano tiene más de 4 metilenos en una cadena lineal, ¿cómo se le distingue en un espectro de IR? 4) ¿Cómo distingue un alcano, un alqueno y un alquino en un espectro de IR? 5) ¿Cómo distingue un aldehído de una cetona en un espectro de IR? 6) ¿Qué vibraciones características presenta un ácido carboxílico para localizarlo en un espectro de IR? 7) ¿Qué bandas le dan la pauta para diferenciar un éster de una cetona? ¿A qué vibración corresponde cada una de ellas? 8) ¿Cómo distingue una amina primaria de una secundaria en un espectro de IR?
- 23. 23 LISTA DE ESPECTROS DE INFRARROJO 1) n-octano 2) Hexadecano 3) 2,3-dimetilbutano 4) 1-hexeno 5) cis-2-hexeno 6) trans-estilbeno 7) 1-hexino 8) Tolueno 9) o-xileno 10) m-xileno 11) p-xileno 12) Terbutilbenceno 13) 1-decanol 14) 2-metil-1-propanol 15) o-cresol 16) 2,6-dimetoxifenol 17) Tetrahidrofurano 18) 3-octanona 19) Linoleato de etilo 20) Ftalato de dioctilo 21) Ácido propiónico 22) 2-etil-butiraldehído 23) 1,4-diaminobutano 24) N-metilanilina
- 24. 24 Espectros de IR 100.0 90 80 721.43 70 1379.67 60 50 %T 1464.42 40 30 2960.00 2874.24 20 1 2855.99 10 2925.00 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 80 70 1379.40 60 720.44 50 %T 40 30 1464.95 20 2957.1 2 2852.5 10 9 2924.99 8 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 25. 25 100.0 90 80 1126.15 1038.69 70 60 1379.91 1370.23 50 %T 1463.12 40 30 2875.27 3 20 10 2962.50 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 554.14 1821.10 1295.36 80 1103.10 741.83 70 631.67 60 1379.95 50 %T 3079.67 40 1640.75 30 993.51 1462.99 4 20 2961.98 2860.98 10 2927.48 2874.61 909.64 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 26. 26 100.0 90 80 70 60 1658.88 50 %T 40 1404.93 30 1379.50 2871.39 20 2960.65 1459.14 690.55 5 10 2934.99 3015.49 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 80 1579.95 3079.47 70 3060.03 60 1599.69 3025.05 50 %T 40 1495.91 30 1454.69 20 10 965.80 769.28 699.09 6 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 27. 27 100.0 90 80 70 60 50 2116.87 1249.84 %T 1380.25 40 1433.98 30 644.91 1467.48 20 7 10 2871.84 3305.00 0.0 2961.19 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 520.55 1735.31 80 70 1857.71 1942.00 1802.48 60 1379.83 50 %T 40 2871.89 30 3085.04 1604.33 3061.15 1460.23 20 2920.43 10 728.51 8 3027.49 1495.06 0.0 694.71 4000.0 3000 2000 1500 1000 400.0 cm-1
- 28. 28 100.0 90 1900.03 80 1788.51 70 1604.71 60 1384.76 3064.60 2877.17 50 %T 40 1455.36 30 3016.08 2920.90 2939.87 1465.18 20 2970.14 1495.23 9 10 742.29 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 1931.46 1852.47 80 1770.73 70 60 1377.18 50 2863.63 %T 1460.22 40 1492.99 30 3015.82 1610.98 2920.83 690.79 20 10 10 769.19 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 29. 29 100.0 90 1792.56 80 1629.92 1890.01 70 1379.35 60 50 %T 1454.77 40 3044.92 2868.17 30 11 3019.66 20 2999.71 10 2922.11 1515.57 794.92 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 1667.75 1940.421739.89 1533.80 80 1865.81 1796.04 70 1201.14 60 1393.91 50 3084.73 1600.01 %T 40 3021.02 3057.42 1469.60 1029.91 30 1268.29 1445.00 20 2865.43 12 1364.87 2901.38 10 1494.97 2957.11 759.85 0.0 694.67 4000.0 3000 2000 1500 1000 400.0 cm-1
- 30. 30 100.0 90 80 70 1122.34 720.11 60 1379.83 50 %T 40 1468.23 1058.01 30 3332.05 20 13 10 2856.76 0.0 2926.37 4000.0 3000 2000 1500 1000 605.0 cm-1 100.0 90 80 70 60 50 %T 40 1379.03 30 1040.23 14 20 2878.52 1461.42 10 2965.00 2934.04 957.29 3368.33 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 31. 31 100.0 90 80 70 60 2922.85 50 3034.08 %T 40 30 15 1330.33 20 3450.00 1593.56 10 1493.99 751.61 1464.71 0.0 1242.26 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 80 70 890.55 3004.40 823.04 60 2840.36 50 2942.83 1031.07 %T 40 3507.83 716.97 30 764.23 1362.70 20 1617.38 1465.04 1507.68 16 10 1480.78 1284.87 1240.53 1103.03 0.0 1214.53 4000.0 3000 2000 1500 1000 400.0 cm-1
- 32. 32 100.0 90 80 70 658.42 1364.77 60 1289.04 50 1459.76 %T 40 30 20 17 10 2859.99 1067.72 2974.46 911.07 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 3413.45 80 70 60 1105.45 50 %T 1413.99 40 30 1460.99 20 2877.73 1377.16 18 10 2936.46 1713.39 0.0 2962.55 4000.0 3000 2000 1500 1000 400.0 cm-1
- 33. 33 100.0 90 3468.77 80 1656.89 70 60 50 %T 40 724.48 30 1035.98 20 3013.44 1374.63 19 10 2924.99 2858.88 1464.14 1743.21 0.0 1184.54 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 3065.05 80 1599.70 955.44 1579.93 70 1038.53 60 1380.39 739.77 50 %T 1463.01 40 30 2869.73 20 20 1121.16 10 2957.66 1727.45 2929.23 1273.08 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1
- 34. 34 100.0 90 80 70 60 934.46 50 1385.04 845.94 %T 1078.25 40 30 1466.34 1416.41 21 20 2986.52 2947.50 1239.37 10 1717.50 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 3432.54 80 70 60 1384.59 50 %T 1460.72 40 2709.17 30 2810.55 22 20 1727.34 10 2966.17 2879.90 0.0 2936.17 4000.0 3000 2000 1500 1000 400.0 cm-1
- 35. 35 100.0 90 80 70 60 1474.19 1389.80 1071.38 1450.24 50 %T 40 3364.17 1604.76 30 3285.79 840.09 23 20 10 2928.79 2854.26 0.0 4000.0 3000 2000 1500 1000 400.0 cm-1 100.0 90 80 70 985.78 60 1446.17 868.31 3021.99 2797.66 1420.42 1068.92 50 2888.33 %T 1149.77 40 3372.03 1175.68 30 24 1259.80 20 1318.69 10 1512.96 690.60 0.0 1598.16 749.62 4000.0 3000 2000 1500 1000 400.0 cm-1
- 36. 36 VII. BIBLIOGRAFÍA a) Allinger, N.L. (1984). Química Orgánica. (2ª ed.). Barcelona; México: Reverte. b) Bruice, P.Y. (2008). Química Orgánica. (5ª ed.). México: Pearson Educación. Carey, F.A. (2006). Química Orgánica. (6ª ed.). México: McGraw-Hill Interamiericana. c) McMurry, J. (2008). Química Orgánica. (7ª ed.). México: Cengage Learning. d) Morrison, R.T. y Boyd, R.N. (1988). Química Orgánica. (5ª ed.). Boston, Massachussets: Addison-Wesley Iberoamericana. e) Pine, S. (1988). Química Orgánica. (2ª ed.). México: McGraw-Hill. f) Pretsch, E., Bühlmann, P. and Badertscher, M. (2009). Structure Determination of Organic Compounds: Tables of Spectral Data. (4th rev. and enl. ed.). Berlin: Springer Verlag. g) Roberts, J.D. (1967). Modern Organic Chemistry. New York: W.A. Benjamin. h) Solomons, T.W.G. (1999). Química Orgánica. (2ª ed.). México: Limusa-Wiley. i) Wade, L.G.Jr. (2004). Química Orgánica. (5ª ed.). España: Prentice Hall.
- 37. 37 PRÁCTICA 1 SUSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR OBTENCIÓN DE BROMURO DE n-BUTILO I. OBJETIVOS a) Obtener un haluro de alquilo primario a partir de un alcohol primario mediante una reacción de sustitución nucleofílica. b) Investigar el mecanismo y las reacciones competitivas que ocurren durante la reacción. c) Identificar el halogenuro obtenido a través de reacciones sencillas. II. REACCIÓN OH + NaBr + H2SO4 H Br + NaHSO4 + H2O n-Butanol Bromuro de n-butilo Masa molar (g/mol) Densidad (g/mL) Punto de fusión o ebullición (°C) Masa (g) Volumen (mL) Cantidad de sustancia (mol)
- 38. 38 III. MATERIAL Agitador de vidrio 1 Pipeta de 10 mL 1 Anillo metálico 1 Porta termómetro 1 Baño de agua eléctrico 1 Probeta graduada 25 mL 1 Colector 1 Recipiente de peltre 1 Columna Vigreaux 1 Refrigerante 1 Embudo de adición 1 “T” de destilación 1 Espátula de acero inoxidable 1 “T” de vacío 1 Manguera de hule para conexión 1 Tapón esmerilado 14/23 1 Mangueras p/refrigerante 2 Tapón para matraz Erlenmeyer de 1 50mL Matraz bola QF de 25 mL 1 Tela de alambre c/asbesto 1 Matraz Erlenmeyer de 50 mL 2 Termómetro -10 a 400 ºC 1 Matraz Kitazato 1 Tubo de vidrio de 20 cm con 1 manguera Matraz pera de dos bocas de 50 mL 1 Tubos de ensaye 2 Mechero con manguera 1 Vaso de pp de 250 mL 1 Pinzas para tubo de ensaye 1 Vidrio de reloj 1 Pinzas de tres dedos con nuez 3 IV. REACTIVOS Ácido sulfúrico 5.0 mL Disolución de NaHCO3 10.0 mL concentrado 10% Alcohol n-butílico 5.0 mL Disolución de NaOH 10% 15.0 mL Bromuro de sodio 7.0 g Disolución de nitrato de 1 mL plata al 5% Disolución de Br2 en CCl4 1 mL Etanol 1 mL Sulfato de sodio anhidro 5.0 g IV. INFORMACIÓN Los halogenuros de alquilo son todos los compuestos de fórmula general R- X, donde R- es un grupo alquilo y –X es un halógeno. La conversión de alcoholes en haluros de alquilo se puede efectuar por varios procedimientos. Con alcoholes primarios y secundarios se usan frecuentemente cloruro de tionilo o haluros de fósforo; también se pueden obtener calentando el alcohol con ácido clorhídrico concentrado y cloruro de zinc anhidro, o usando ácido sulfúrico concentrado y bromuro de sodio. Los alcoholes terciarios se convierten al haluro de alquilo correspondiente sólo con ácido clorhídrico y en algunos casos sin necesidad de calentar.
- 39. 39 VI. PROCEDIMIENTO En un matraz pera de dos bocas de 50 mL coloque 5 mL de agua, añada 7 g de bromuro de sodio, agite, y adicione 5 mL de n-butanol. Mezcle perfectamente, añada cuerpos de ebullición, adapte un sistema de destilación fraccionada, y adapte una trampa de disolución de sosa (25 mL), como lo indica la figura 16. Enfríe el matraz en un baño de hielo y pasados unos minutos adicione por la boca lateral del matraz 5 mL de ácido sulfúrico concentrado en porciones de aproximadamente 1 mL cada vez mediante un embudo de adición, (Nota 1). Terminada la adición, retire el baño de hielo y el embudo de adición y tape la boca lateral del matraz de pera con el tapón esmerilado. Caliente la mezcla de reacción suavemente empleando un baño de aire. Se empieza a notar el progreso de la reacción por la aparición de dos fases, siendo la fase inferior la que contiene el bromuro de n-butilo (Nota 2). Reciba el destilado en un recipiente enfriado en un baño de hielo (Nota 3). Continúe el calentamiento hasta que el destilado sea claro y no contenga gotas aceitosas (Nota 4). Pase el destilado al embudo de separación y separe la fase acuosa. Lave dos veces la fase orgánica con porciones de 5 mL de solución de bicarbonato de sodio al 10% cada vez, Figura 16 verifique que el pH no sea ácido (en caso necesario haga otro lavado). Haga un lavado final con 5 mL de agua, transfiera el bromuro de n-butilo húmedo a un matraz Erlenmeyer de 50 mL y séquelo con sulfato de sodio anhidro. Mida el volumen obtenido y determine el rendimiento. NOTAS 1) ¡CUIDADO! El ácido sulfúrico causa severas quemaduras. Use lentes de seguridad y agite después de cada adición. 2) La densidad del bromuro de n-butilo es de 1.286 g/mL a 24 °C. 3) En el condensador se forma una mezcla aceitosa de agua con bromuro de n-butilo. 4) Analice cuidadosamente cada uno de los pasos involucrados en este procedimiento; trabaje con ventilación adecuada ya que puede haber desprendimiento de HBr.
- 40. 40 PRUEBAS DE IDENTIFICACIÓN 1. Identificación de Halógenos: En un tubo de ensaye limpio y seco, coloque tres gotas del halogenuro obtenido, adicione 0.5 mL de etanol y 5 gotas de solución de nitrato de plata al 5%. Agite y caliente en baño María por 5 min. La prueba es positiva si se forma un precipitado blanco insoluble en ácido nítrico. 2. Presencia de insaturaciones: En un tubo de ensaye limpio y seco coloque 5 gotas del haluro obtenido y adicione 1 mL de solución de bromo en CCl4 y agite, observe e interprete los resultados. VII. ANTECEDENTES 1) Sustitución nucleofílica alifática. 2) Reacciones de alcoholes con halogenuros de hidrógeno. 3) Utilidad industrial de la sustitución nucleofílica alifática como método de síntesis de diferentes materias primas. 4) Escriba un cuadro comparativo de las reacciones tipo SN1 y SN2 respecto a: a) Orden de reacción b) Estereoquímica c) Condiciones de reacción d) Sustrato e) Reacciones en competencia f) Subproductos y productos orgánicos colaterales 5) Propiedades físicas, químicas y toxicidad de reactivos y productos. VIII. CUESTIONARIO 1) Clasifique los siguientes halogenuros como primarios, secundarios, terciarios, arílicos o bencílicos. a) b) c) d) Cl Cl Et Cl e) Cl Cl 2) De las siguientes reacciones dé las estructuras de los productos de sustitución (si los hay), y diga bajo qué mecanismo proceden.
- 41. 41 Cl a) CH3CH2CH2I + HCl b) - + OH/H2O, T° ambiente c) H2C CH CH(CH3)2 + HCl d) - + OH/H2O Br 3) Prediga cuál de los siguientes alcoholes reaccionará más rápido frente a HBr: a) Alcohol bencílico b) Alcohol p-metil-bencílico c) Alcohol p-nitrobencílico 4) Escriba el mecanismo de la reacción de sustitución nucleofílica alifática entre el ter-butanol y HBr. 5) ¿Dónde se encontraba la fase orgánica cuando la separó de la mezcla de reacción? ¿Y cuándo la lavó? ¿Cómo lo supo? 6) ¿Qué sustancias contienen los residuos de este experimento? ¿Qué tratamiento previo se les debe de dar antes de desecharlos al drenaje? 7) Asigne las bandas principales a los grupos funcionales presentes en los espectros de IR de reactivos y productos.
- 42. 42 Espectros de IR a) n-Butanol 100.0 90 80 899.44 70 60 1214.52 %T 50 844.91 40 734.91 1112.03 645.00 30 1379.43 950.32 20 3347.50 2942.50 1042.33 1464.07 1072.21 989.69 10.2 4000.0 3000 2000 1500 1000 500 295.0 cm-1 a) Bromuro de n-butilo 100.0 90 1078.42 796.71 80 994.05 70 951.72 60 50 1294.94 915.04 %T 866.70 40 1380.11 740.44 562.31 30 643.68 20 1464.53 2933.80 1438.05 1216.12 10 2960.37 1261.72 2.0 2873.55 4000.0 3000 2000 1500 1000 450.0 cm-1
- 43. 43 H2O + NaBr OBTENCIÓN DE BROMURO Agitar DE n-BUTILO Adicionar n-BuOH Adaptar sistema de destilación con trampa de sosa Enfriar Adicionar 2 mL de H2SO4(c) cada vez, destilar NaBr n-BuOH Bromuro de n-butilo NaOH NaBr impuro NaHSO4 D1 Separar fases D2 Fase ogánica Fase acuosa n-BuOH/H2SO4 Bromuro de n-butilo sin reaccionar Impuro D3 Lavar con soln. NaHCO3 al 10% Verificar pH Secar con Na2SO4 anh. Lavar con agua ANH.AN ANA Fase orgánica Fase acuosa Bromuro de n-butilo puro Na2SO4 H2O D4 D1, D2, D4: Checar pH, neutralizar, filtrar sólidos y mandarlos a incinerar. El líquido se puede desechar por el drenaje. D3: Destilar el n-butanol, neutralizar el residuo del destilado y desechar por el drenaje.
- 44. 44 PRUEBAS DE IDENTIFICACIÓN Bromuro de n-butilo Tomar muestras 1) EtOH 1) Br2/CCl4 2) AgNO3 5% pp blanco insoluble Bromuro de n-butilo + + Ácido nítrico Br2/CCl4 D6 D5 D5: Filtrar la solución y el filtrado se neutraliza para poder desecharlo. D6: Mandar a incineración.
- 45. 45 IX. BIBLIOGRAFÍA a) Allinger, N.L. (1984). Química Orgánica. (2ª ed.). Barcelona; México: Reverte. b) Ávila, A.J.G. et al. (2009). Química Orgánica. Experimentos con un enfoque ecológico. (2ª ed.). México: UNAM, Dirección General de Publicaciones y Fomento Editorial. c) Brewster, R.Q., Vanderweft, C.A. and Mc-Ewen, W.E. (1970). Curso Práctico de Química Orgánica. Madrid: Alhambra. d) Bruice, P.Y. (2008). Química Orgánica. (5ª ed.). México: Pearson Educación. Carey, F.A. (2006). Química Orgánica. (6ª ed.). México: McGraw-Hill Interamiericana. e) Fieser, L.F. (1992). Organic Experiments. (7th ed.). Lexington, Massachusetts: D.C. Heath. f) Lehman, J.W. (1999). Operational Organic Chemistry: A Problem-Solving Approach to the Laboratory Course. (3rd ed.). Upper Saddle River, New Jersey: SunSoft: Prentice Hall Title. g) McMurry, J. (2008). Química Orgánica. (7ª ed.). México: Cengage Learning. h) Mohring, J.R. and Neckers, D.C. (1973). Laboratory Experiments in Organic Chemistry. (2nd ed). New York: D. van Nostrand Company, Inc. i) Morrison, R.T. y Boyd, R.N. (1988). Química Orgánica. (5ª ed.). Boston, Massachussets: Addison-Wesley Iberoamericana. j) Pavia, D.L. (2007). Introduction to Organic Laboratory Techniques: A Microscale Approach. Belmont California: Thomson Brooks/Cole. Laboratory Series for Organic Chemistry. k) Pavia, D.L., Lampman, G.M. and Kriz, G.S. (1988). Introduction to Organic Laboratory techniques: A Contemporary approach. Phildelphia: Saunders College. l) Pine, S. (1988). Química Orgánica. (2ª ed.). México: McGraw-Hill. m) Pretsch, E., Bühlmann, P. and Badertscher, M. (2009). Structure Determination of Organic Compounds: Tables of Spectral Data. (4th rev. and enl. ed.). Berlin: Springer Verlag. n) Roberts, J.D. (1967). Modern Organic Chemistry. New York: W.A. Benjamin.
- 46. 46 o) Solomons, T.W.G. (1999). Química Orgánica. (2ª ed.). México: Limusa-Wiley. p) Vogel, A.I. (1989). A Textbook of Practical Organic Chemistry. (5th ed.) New York: Longmans Scientifical and Technical. q) Vogel, Q.I. (1978). Vogel´s Textbook of Practical Organic Chemistry, including Qualitative Organic Analysis. (4th rev. ed.). London: Lonngman. r) Wade, L.G.Jr. (2004). Química Orgánica. (5ª ed.). España: Prentice Hall.
- 47. 47 PRÁCTICA 2 SUSTITUCIÓN NUCLEOFÍLICA UNIMOLECULAR: OBTENCIÓN DE CLORURO DE TERBUTILO I. OBJETIVOS a) Obtener un haluro de alquilo terciario a partir de un alcohol terciario mediante una reacción de sustitución nucleofílica. b) Investigar el mecanismo y las reacciones competitivas que ocurren durante la reacción. II. REACCIÓN CH3 CH3 CH3 CH3 + HCl + H 2O CH3 OH CH3 Cl t-Butanol Cloruro de t-butilo Masa molar (g/mol) Densidad (g/mL) Punto de fusión o ebullición (°C) Masa (g) Volumen (mL) Cantidad de sustancia (mol)
- 48. 48 III. MATERIAL Agitador magnético 1 Pinzas de tres dedos con nuez 3 Baño de agua eléctrico 1 Pipeta de 10 mL 1 Barra de agitación magnética 1 Portatermómetro 1 Colector 1 Probeta graduada 25 mL 1 Embudo de separación 1 Recipiente de peltre 1 Embudo de filtración rápida 1 Refrigerante 1 Espátula de acero inoxidable 1 Vaso de pp de 250 mL 1 Colector 1 “T” de destilación 1 Mangueras p/refrigerante 2 Tapón de corcho (No. 5) 1 Matraz bola QF de 25 mL 1 Tapón esmerilado 14/23 1 Matraz Erlenmeyer de 50 mL 3 Termómetro -10 a 400 ºC 1 Matraz Erlenmeyer de 125 mL 1 Tubos de ensaye 2 Pinzas para tubo de ensaye 1 Vidrio de reloj 1 IV. REACTIVOS Ácido clorhídrico concentrado 18 mL Solución de carbonato de sodio 10 mL al 5 % Alcohol terbutílico 6 mL Sulfato de sodio anhidro 1g Cloruro de calcio 2g V. INFORMACIÓN Los halogenuros de alquilo son todos los compuestos de fórmula general R-X, donde R es un grupo alquilo y –X es un halógeno. La conversión de alcoholes en haluros de alquilo se puede efectuar por varios procedimientos. Con alcoholes primarios y secundarios se usan frecuentemente cloruro de tionilo o haluros de fósforo; también se pueden obtener calentando el alcohol con ácido clorhídrico concentrado y cloruro de zinc anhidro, o usando ácido sulfúrico concentrado y bromuro de sodio. Los alcoholes terciarios se convierten al haluro de alquilo correspondiente sólo con ácido clorhídrico y en algunos casos sin necesidad de calentar.
- 49. 49 VI. PROCEDIMIENTO En un matraz Erlenmeyer de 125 mL con tapón coloque 6 mL de terbutanol, 18 mL de ácido clorhídrico concentrado, 2.0 g de cloruro de calcio y mézclelos con agitación vigorosa por medio de un agitador magnético durante 15 minutos. Transfiera el contenido del matraz a un embudo de separación, deje reposar hasta la separación de fases, elimine la capa inferior (Nota 1), lave el cloruro de ter-butilo formado con 5 mL de una solución de carbonato de sodio al 5% (Nota 2). Seque el cloruro de ter-butilo con sulfato de sodio anhidro y purifíquelo por destilación simple (Nota 3). Recoja la fracción que destila entre 42-45 ºC. De ser necesario, vuélvala a secar con sulfato de sodio anhidro. NOTAS 1) La densidad del cloruro de ter-butilo es de 0.851 g/mL a 25 °C. 2) Durante los lavados el cloruro de ter-butilo queda en la fase superior. Checar que el pH de la fase acuosa sea neutro, de no ser así, realice un lavado más, hasta verificar que el pH sea neutro. 3) Use un sistema de destilación sencilla, caliente el matraz sumergido en un baño María. Reciba el destilado en un matraz sumergido en un baño de hielo. PRUEBAS DE IDENTIFICACIÓN 1. Identificación de Halógenos: En un tubo de ensaye limpio y seco, coloque tres gotas del halogenuro obtenido, adicione 0.5 mL de etanol y 5 gotas de solución de nitrato de plata al 5%. Agite y caliente en baño María por 5 min. La prueba es positiva si se forma un precipitado blanco insoluble en ácido nítrico. 2. Presencia de insaturaciones: En un tubo de ensaye limpio y seco coloque 5 gotas del haluro obtenido y adicione 1 mL de agua de bromo y agite, observe e interprete los resultados.
- 50. 50 VII. ANTECEDENTES 1) Sustitución nucleofílica alifática. 2) Reacciones de alcoholes con halogenuros de hidrógeno. 3) Utilidad industrial de la sustitución nucleofílica alifática como método de síntesis de diferentes materias primas. 4) Escriba un cuadro comparativo de las reacciones tipo SN1 y SN2 respecto a: a) Orden de reacción b) Estereoquímica c) Condiciones de reacción d) Sustrato e) Reacciones en competencia f) Subproductos y productos orgánicos colaterales 5) Propiedades físicas, químicas y toxicidad de los reactivos y productos. VIII. CUESTIONARIO 1) Clasifique los siguientes halogenuros como primarios, secundarios, terciarios, arílicos o bencílicos. a) b) c) d) Cl Cl Et Cl e) Cl Cl 2) De las siguientes reacciones dé las estructuras de los productos de sustitución (si los hay), y diga bajo qué mecanismo proceden. Cl a) CH3CH2CH2I + HCl b) - + OH/H2O, T° ambiente c) H2C CH CH(CH3)2 + HCl d) - + OH/H2O Br
- 51. 51 3) Prediga cuál de los siguientes alcoholes reaccionará más rápido frente a HBr: a) Alcohol bencílico b) Alcohol p-metilbencílico c) Alcohol p-nitrobencílico 4) Escriba el mecanismo de la reacción de sustitución nucleofílica alifática entre el n-butanol y HBr. 5) ¿Dónde se encontraba la fase orgánica cuando la separó de la mezcla de reacción? ¿Y cuándo la lavó? ¿Cómo lo supo? 6) ¿Qué sustancias contienen los residuos de este experimento? ¿Qué tratamiento previo se les debe de dar antes de desecharlos al drenaje? 7) Asigne las bandas principales a los grupos funcionales presentes en los espectros de IR de reactivos y productos.
- 52. 52 Espectros de IR a) ter-Butanol b) Cloruro de terbutilo
- 53. 53 OBTENCIÓN DEL CLORURO DE TERBUTILO Terbutanol HCl, CaCl2 1) Agitar 15´ 2) Separar fases Fase orgánica Fase acuosa HCl Cloruro de t-butilo impuro, H2O, HCl D1 Fase orgánica Fase acuosa Secar con Na2SO4 Líquido Sólido H2O, HCl, t-BuOH Cloruro de Na2SO4 terbutilo H2O D2 Destilar D3 Cloruro de t-butilo Residuos de puro destilado D4 D1, D3: Checar pH, neutralizar y desechar por el drenaje. D2: Si contiene t-butanol, destilar el agua y mandar el residuo a incineración. D4: Mandar a incineración.
- 54. 54 PRUEBAS DE IDENTIFICACIÓN Cloruro de t-butilo Tomar muestras 1) EtOH 1) Br2/CCl4 2) AgNO3 5% pp blanco insoluble Cloruro de t-butilo + + Ácido nítrico Br2/CCl4 D6 D5 D5: Filtrar la solución y el filtrado se neutraliza para poder desecharlo. D6: Mandar a incineración.
- 55. 55 IX. BIBLIOGRAFÍA a) Allinger, N.L. (1984). Química Orgánica. (2ª ed.). Barcelona; México: Reverte. b) Ávila, A.J.G. et al. (2009). Química Orgánica. Experimentos con un enfoque ecológico. (2ª ed.). México: UNAM, Dirección General de Publicaciones y Fomento Editorial. c) Brewster, R.Q., Vanderweft, C.A. and Mc-Ewen, W.E. (1970). Curso Práctico de Química Orgánica. Madrid: Alhambra. d) Bruice, P.Y. (2008). Química Orgánica. (5ª ed.). México: Pearson Educación. Carey, F.A. (2006). Química Orgánica. (6ª ed.). México: McGraw-Hill Interamiericana. e) Fieser, L.F. (1992). Organic Experiments. (7th ed.). Lexington, Massachusetts: D.C. Heath. f) Lehman, J.W. (1999). Operational Organic Chemistry: A Problem-Solving Approach to the Laboratory Course. (3rd ed.). Upper Saddle River, New Jersey: SunSoft: Prentice Hall Title. g) McMurry, J. (2008). Química Orgánica. (7ª ed.). México: Cengage Learning. h) Mohring, J.R. and Neckers, D.C. (1973). Laboratory Experiments in Organic Chemistry. (2nd ed). New York: D. van Nostrand Company, Inc. i) Morrison, R.T. y Boyd, R.N. (1988). Química Orgánica. (5ª ed.). Boston, Massachussets: Addison-Wesley Iberoamericana. j) Pavia, D.L. (2007). Introduction to Organic Laboratory Techniques: A Microscale Approach. Belmont California: Thomson Brooks/Cole. Laboratory Series for Organic Chemistry. k) Pavia, D.L., Lampman, G.M. and Kriz, G.S. (1988). Introduction to Organic Laboratory techniques: A Contemporary approach. Phildelphia: Saunders College. l) Pine, S. (1988). Química Orgánica. (2ª ed.). México: McGraw-Hill. m) Pretsch, E., Bühlmann, P. and Badertscher, M. (2009). Structure Determination of Organic Compounds: Tables of Spectral Data. (4 th rev. and enl. ed.). Berlin: Springer Verlag. n) Roberts, J.D. (1967). Modern Organic Chemistry. New York: W.A. Benjamin.
- 56. 56 o) Solomons, T.W.G. (1999). Química Orgánica. (2ª ed.). México: Limusa-Wiley. p) Vogel, A.I. (1989). A Textbook of Practical Organic Chemistry. (5th ed.) New York: Longmans Scientifical and Technical. q) Vogel, Q.I. (1978). Vogel´s Textbook of Practical Organic Chemistry, including Qualitative Organic Analysis. (4th rev. ed.). London: Lonngman. r) Wade, L.G.Jr. (2004). Química Orgánica. (5ª ed.). España: Prentice Hall.
- 57. 57 PRÁCTICA 3 DESHIDRATACIÓN DE ALCOHOLES: PREPARACIÓN DE CICLOHEXENO I. OBJETIVOS a) Preparar ciclohexeno por deshidratación catalítica de ciclohexanol. b) Comprender la influencia de factores experimentales que modifican una reacción reversible. II. REACCIÓN OH H2SO4 + H2O Ciclohexanol Ciclohexeno Masa molar (g/mol) Densidad (g/mL) Punto de fusión o ebullición (°C) Masa (g) Volumen (mL) Cantidad de sustancia (mol)
- 58. 58 III. MATERIAL Agitador de vidrio 1 Pinzas para tubo de ensaye 1 Anillo metálico 1 Portatermómetro 1 Colector 1 Probeta graduada de 25 mL 1 Columna Vigreaux 1 Recipiente de peltre 1 Embudo de separación 1 Refrigerante 1 Embudo de tallo corto 1 “T” de destilación 1 Espátula de acero inoxidable 1 “T” de vacío 1 Manguera de hule para conexión 1 Tapón esmerilado 14/23 1 Mangueras para refrigerante 2 Tapón monohoradado 1 Matraz bola QF de 25 mL 1 Tela de alambre con asbesto 1 Matraz Erlenmeyer de 50 mL 2 Termómetro -10 a 400 ºC 1 Matraz Kitazato 1 Tubos de ensaye 2 Matraz pera de dos bocas de 1 Tubo de vidrio de 20 cm 1 50 mL Mechero con manguera 1 Vaso de pp de 100 mL 1 Pipeta graduada de 10 mL 1 Vaso de pp de 250 mL 1 Pinzas de tres dedos con nuez 3 Vidrio de reloj 1 IV. REACTIVOS Ácido sulfúrico concentrado 0.5 mL Disoln. de Br2 en CCl4 1.0 mL Bicarbonato de sodio 2.0 g Disoln. de KMnO4 al 25.0 mL 0.2% Ciclohexanol 10.0 mL Sulfato de sodio anhidro 2.0 g Disoln. de NaHCO3 al 5% 15.0 mL Tetracloruro de carbono 5.0 mL Disoln. saturada de 15.0 mL NaHCO3 V. INFORMACIÓN a) La reacción para obtener ciclohexeno a partir de ciclohexanol es reversible. b) La reversibilidad de una reacción se puede evitar: i) Si se elimina el producto del medio de reacción a medida que ésta progresa. ii) Si se aumenta la concentración de uno o varios de los reactivos. iii) Si se aumenta o disminuye la temperatura en el sentido que se favorezca la reacción directa, etc.
- 59. 59 c) Por lo tanto, las condiciones experimentales en las que se efectúa una reacción determinan los resultados de ésta, en cuanto a calidad y cantidad del producto obtenido. VI. PROCEDIMIENTO Preparar el ciclohexeno a partir de ciclohexanol por dos procedimientos diferentes (Método A y Método B) y comparar los resultados obtenidos en cuanto a calidad y cantidad del producto, con el fin de determinar qué método es más eficiente. Luego se comprobará a través de reacciones específicas de identificación, la presencia de enlaces dobles C=C en el ciclohexeno obtenido (pruebas de insaturación). Método A. Por destilación fraccionada. Monte un equipo de destilación fraccionada (Nota 1). En el matraz pera de dos bocas de 50 mL coloque 10 mL de ciclohexanol, por una de las bocas adapte el embudo de separación y adicione gota a gota y agitando 0.5 mL de ácido sulfúrico concentrado, agregue cuerpos de ebullición y adapte el resto del equipo. Posteriormente vierta en la trampa 25 mL de la disolución de permanganato de potasio. Emplee un baño de aire y caliente moderadamente el vaso de precipitados con el mechero, a través de la tela de asbesto. Reciba el destilado en el matraz bola y colecte todo lo que destile entre 80-85 °C enfriando con un baño de hielo. Suspenda el calentamiento cuando sólo quede un pequeño residuo en el matraz o bien empiecen a aparecer vapores blancos de SO2 (Nota 2). Lave el producto 3 veces con una disolución de bicarbonato de sodio al 5% empleando porciones de 5 mL cada vez (Nota 3). Coloque la fase orgánica en un vaso de precipitados y séquela con sulfato de sodio anhidro. Esta fase orgánica debe ser ciclohexeno, el cual deberá purificar por destilación simple, empleando un baño de aire (Nota 4). Colecte la fracción que destila a la temperatura de ebullición del ciclohexeno (Nota 5) y séquela nuevamente con sulfato de sodio anhidro, mida el volumen obtenido y entréguelo al profesor. Calcule el rendimiento de la reacción. La cabeza y la cola de la destilación pueden utilizarse para hacer las pruebas de insaturación, que se indican al final de este procedimiento.
- 60. 60 Método B. Por reflujo directo. La realización de este método tiene por objeto establecer una comparación con el anterior en cuanto a los resultados que se obtengan. Por esta razón, sólo un alumno lo pondrá en práctica, en tanto que los demás deberán tomar en cuenta este resultado para hacer la comparación respectiva. Monte un equipo de reflujo directo. En el matraz pera de una boca coloque 10 mL de ciclohexanol, agregue gota a gota y agitando 0.5 mL de ácido sulfúrico concentrado, agregue cuerpos de ebullición y adapte el resto del equipo. Caliente el sistema con el mechero a través de la tela de alambre con asbesto, empleando un baño de aire, durante 45 minutos. Luego déjelo enfriar un poco y vierta la mezcla de reacción en 10 mL de una solución saturada de bicarbonato de sodio. Separe entonces la fase orgánica, lávela con 3 porciones de 5 mL de una solución saturada de bicarbonato de sodio y séquela con sulfato de sodio anhidro. Purifique el ciclohexeno obtenido por destilación simple empleando un baño de aire. Mida el volumen obtenido y entréguelo al profesor. Calcule el rendimiento de la reacción. PRUEBAS DE IDENTIFICACIÓN 1) Reacción con Br2/CCl4 En un tubo de ensayo coloque 1 mL de disolución de bromo en tetracloruro de carbono, agregue 1 mL de ciclohexeno y agite. Observe e interprete los resultados. Escriba la reacción que se lleva a cabo. 2) Reacción con KMnO4 En un tubo de ensayo coloque 1 mL de disolución de permanganato de potasio, agregue 1 mL de ciclohexeno y agite. Observe e interprete los resultados. Escriba la reacción que se lleva a cabo. Resuma en el siguiente cuadro los datos experimentales de los dos métodos de obtención del ciclohexeno.
- 61. 61 Condiciones Temperatura de Volumen del Rendimiento Método Experimentales la destilación destilado de la reacción (oC) (mL) (%) A B Tabla 15 NOTAS 1) Para aumentar el gradiente de temperatura en la columna cúbrala exteriormente con fibra de vidrio. 2) Enfríe muy bien el aparato antes de desmontar y coloque el matraz bola con su tapón en un baño de hielo. 3) La densidad del ciclohexeno es de 0.811 g/mL a 25 °C. 4) Tenga cuidado de utilizar el material bien limpio y seco. o 5) El punto de ebullición del ciclohexeno es de 83-84 C a 760 mm de Hg, y como la presión atmosférica en el D. F. es de 570-590 mm de Hg, el o punto de ebullición del ciclohexeno es de 71-74 C. VII. ANTECEDENTES 1) Propiedades físicas, químicas y toxicidad de reactivos y productos. 2) Deshidratación catalítica de alcoholes para obtener alquenos. Mecanismo de reacción. 3) Influencia de las condiciones experimentales en la reversibilidad de una reacción. 4) Reacciones de adición a dobles enlaces. VIII. CUESTIONARIO 1) Con base en los resultados obtenidos, ¿cuál de los dos métodos es el más eficiente para obtener ciclohexeno? Explique por qué. 2) a) ¿Qué es una reacción reversible? b) ¿Qué es una reacción irreversible? c) ¿Qué es una reacción en equilibrio? 3) ¿Cuáles fueron los principales factores experimentales que se controlaron en esta práctica? 4) ¿Qué debe hacer con los residuos de la reacción depositados en el matraz pera antes de desecharlos por el drenaje?
- 62. 62 5) ¿Cuál es la toxicidad de los productos que se forman al realizar las pruebas de insaturación? 6) Asigne las bandas principales a los grupos funcionales presentes en los espectros de IR de reactivos y productos. Espectros de IR a) Ciclohexanol 100.1 90 1714.25 925.22 80 70 789.02 60 1139.78 1174.81 50 %T 2668.41 1238.99 40 889.53 1299.02 30 1025.52 1259.61 844.61 20 2935.10 2860.48 968.32 10 1453.51 1365.22 3.9 3347.12 1069.22 4000.0 3000 2000 1500 1000 605.0 cm-1 b) Ciclohexeno 100.0 90 810.29 80 1385.23 2659.39 1324.77 70 1654.88 1268.51 1039.06 454.49 60 50 %T 1449.39 405.97 40 1139.62 877.40 918.89 30 1440.19 719.89 20 2927.11 643.34 10 3021.68 2860.04 3.8 2839.50 4000.0 3000 2000 1500 1000 500 245.0 cm-1
- 63. 63 OBTENCIÓN DE CICLOHEXENO CICLOHEXANOL H2SO4 (conc.) 1) Destilar RESIDUO DESTILADO H2SO4 Ciclohexeno Mat. org. degradada + Agua 2) Lavar con NaHCO3 (5%) D1 FASE ORGÁNICA FASE ACUOSA Ciclohexeno impuro, húmedo NaHCO3 3) Secar con Na2SO4 Na2SO4 4) Decantar o filtrar D2 LÍQUIDO SÓLIDO Ciclohexeno Na2SO4 impuro D3 5) Destilar DESTILADO RESIDUO D1: Separar fases, mandar a inci- neración la fase orgánica, utilizar la fase acuosa para neutralizar D2. CICLOHEXENO Residuos orgánicos PURO D2: Neutralizar con D1. D4 D3: Secar para uso posterior. 6) Tomar muestras D4: Mandar a incineración. D5: Mandar a incineración. + Br2 + KMnO4 D6: Filtrar el MnO2, etiquetarlo 1,2-Dibromociclohexano MnO2 + Diol y confinarlo. Checar pH al líquido y desechar por el drenaje. D5 D6
- 64. 64 IX. BIBLIOGRAFÍA a) Allinger, N.L. (1984). Química Orgánica. (2ª ed.). Barcelona; México: Reverte. b) Ávila, A.J.G. et al. (2009). Química Orgánica. Experimentos con un enfoque ecológico. (2ª ed.). México: UNAM, Dirección General de Publicaciones y Fomento Editorial. c) Brewster, R.Q., Vanderweft, C.A. and Mc-Ewen, W.E. (1970). Curso Práctico de Química Orgánica. Madrid: Alhambra. d) Bruice, P.Y. (2008). Química Orgánica. (5ª ed.). México: Pearson Educación. Carey, F.A. (2006). Química Orgánica. (6ª ed.). México: McGraw-Hill Interamiericana. e) Fieser, L.F. (1992). Organic Experiments. (7th ed.). Lexington, Massachusetts: D.C. Heath. f) Lehman, J.W. (1999). Operational Organic Chemistry: A Problem-Solving Approach to the Laboratory Course. (3rd ed.). Upper Saddle River, New Jersey: SunSoft: Prentice Hall Title. g) McMurry, J. (2008). Química Orgánica. (7ª ed.). México: Cengage Learning. h) Mohring, J.R. and Neckers, D.C. (1973). Laboratory Experiments in Organic Chemistry. (2nd ed). New York: D. van Nostrand Company, Inc. i) Morrison, R.T. y Boyd, R.N. (1988). Química Orgánica. (5ª ed.). Boston, Massachussets: Addison-Wesley Iberoamericana. j) Pavia, D.L. (2007). Introduction to Organic Laboratory Techniques: A Microscale Approach. Belmont California: Thomson Brooks/Cole. Laboratory Series for Organic Chemistry. k) Pavia, D.L., Lampman, G.M. and Kriz, G.S. (1988). Introduction to Organic Laboratory techniques: A Contemporary approach. Phildelphia: Saunders College. l) Pine, S. (1988). Química Orgánica. (2ª ed.). México: McGraw-Hill. m) Pretsch, E., Bühlmann, P. and Badertscher, M. (2009). Structure Determination of Organic Compounds: Tables of Spectral Data. (4th rev. and enl. ed.). Berlin: Springer Verlag. n) Roberts, J.D. (1967). Modern Organic Chemistry. New York: W.A. Benjamin.
- 65. 65 o) Solomons, T.W.G. (1999). Química Orgánica. (2ª ed.). México: Limusa-Wiley. p) Vogel, A.I. (1989). A Textbook of Practical Organic Chemistry. (5th ed.) New York: Longmans Scientifical and Technical. q) Vogel, Q.I. (1978). Vogel´s Textbook of Practical Organic Chemistry, including Qualitative Organic Analysis. (4th rev. ed.). London: Lonngman. r) Wade, L.G.Jr. (2004). Química Orgánica. (5ª ed.). España: Prentice Hall.
