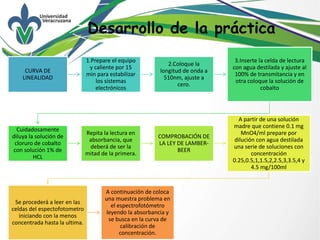
La práctica describe cómo construir una curva de calibración usando un espectrofotómetro para verificar la ley de Beer-Lambert. Los estudiantes prepararon una serie de soluciones de permanganato de potasio con concentraciones conocidas y midieron su absorbancia. Luego trazaron un gráfico de absorbancia vs concentración que mostró una relación lineal directa, verificando la ley de Beer-Lambert. Finalmente, usaron la curva de calibración para determinar la concentración de una muestra desconocida midiendo su absorbancia.