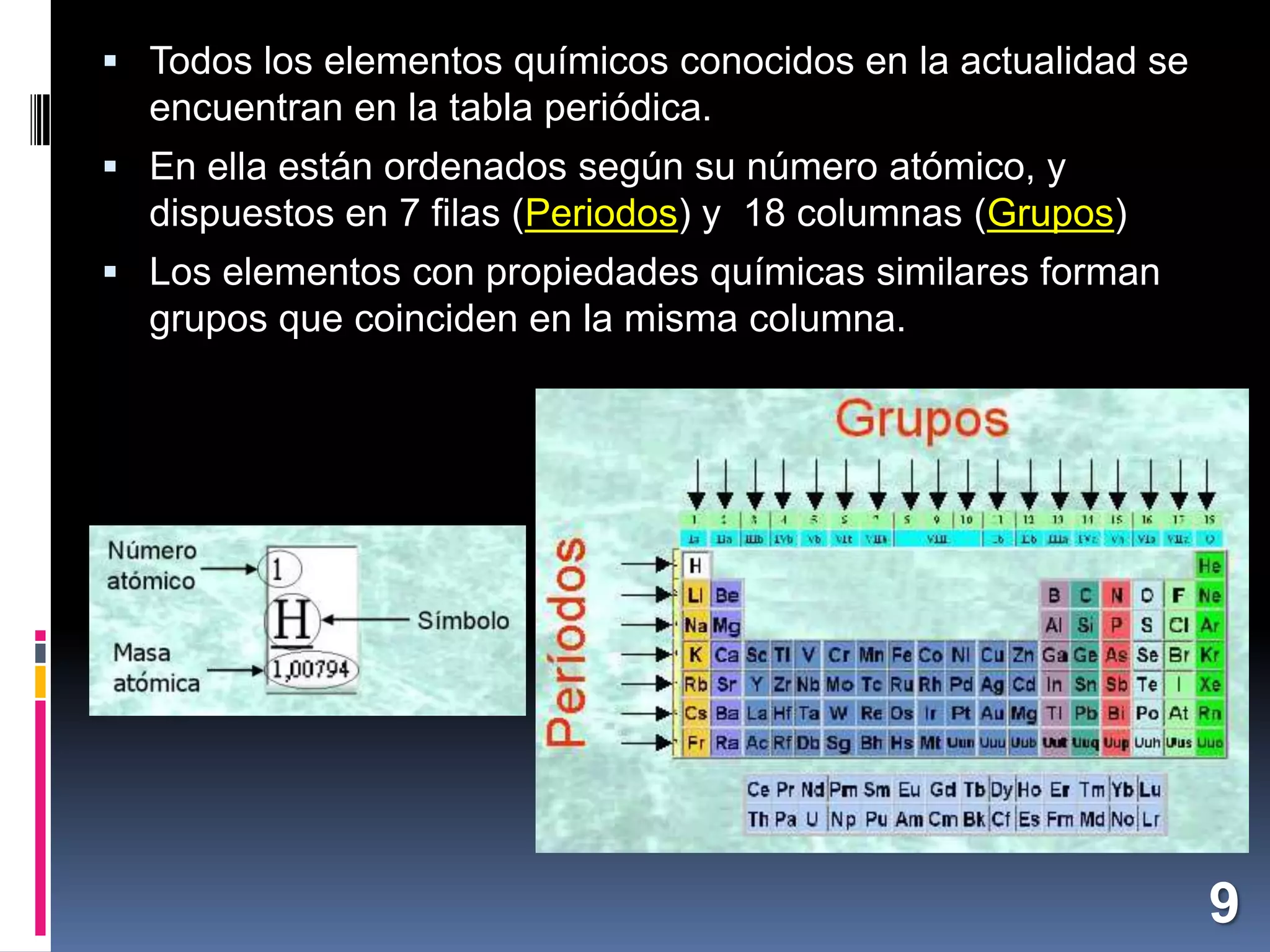
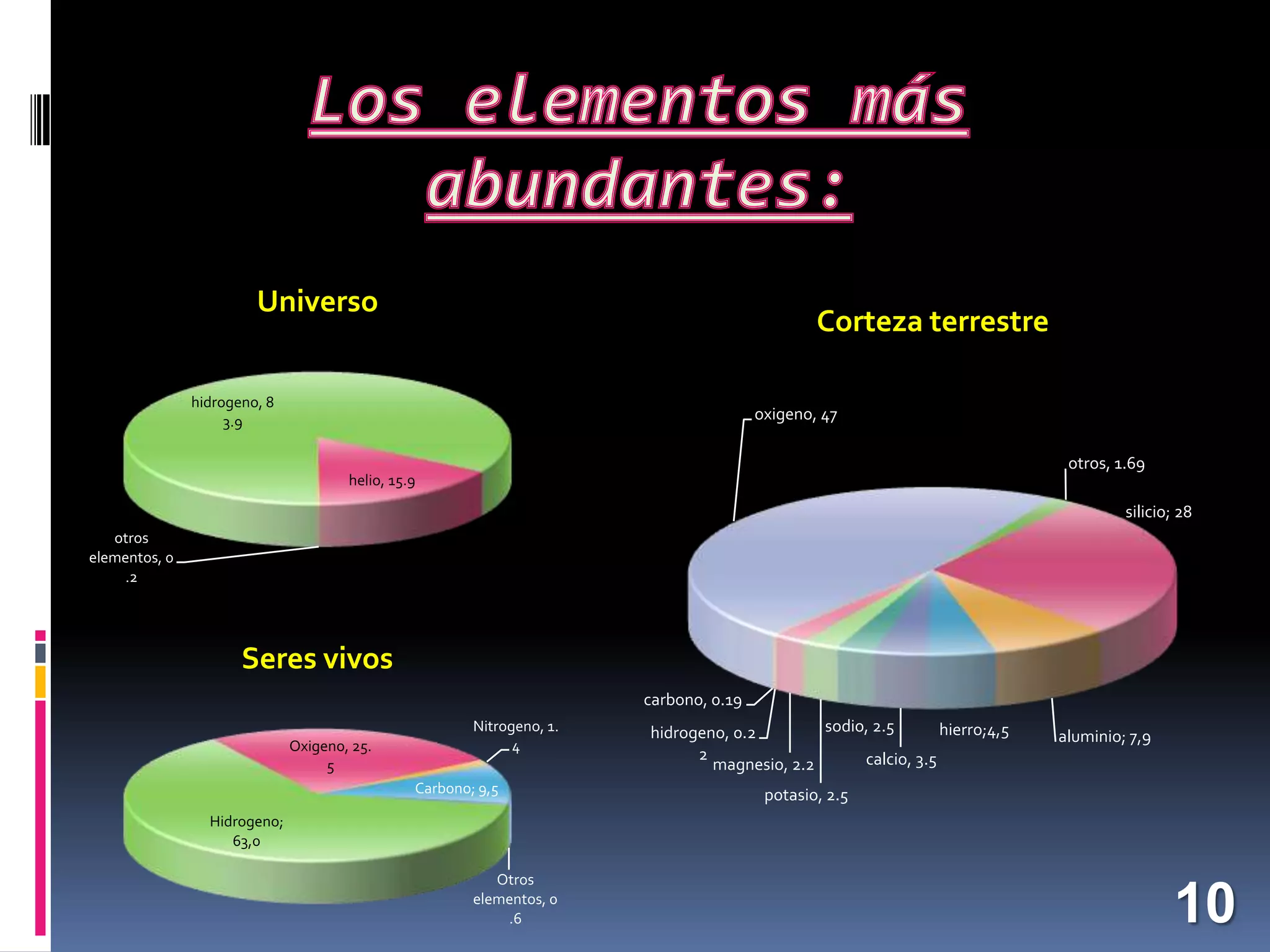
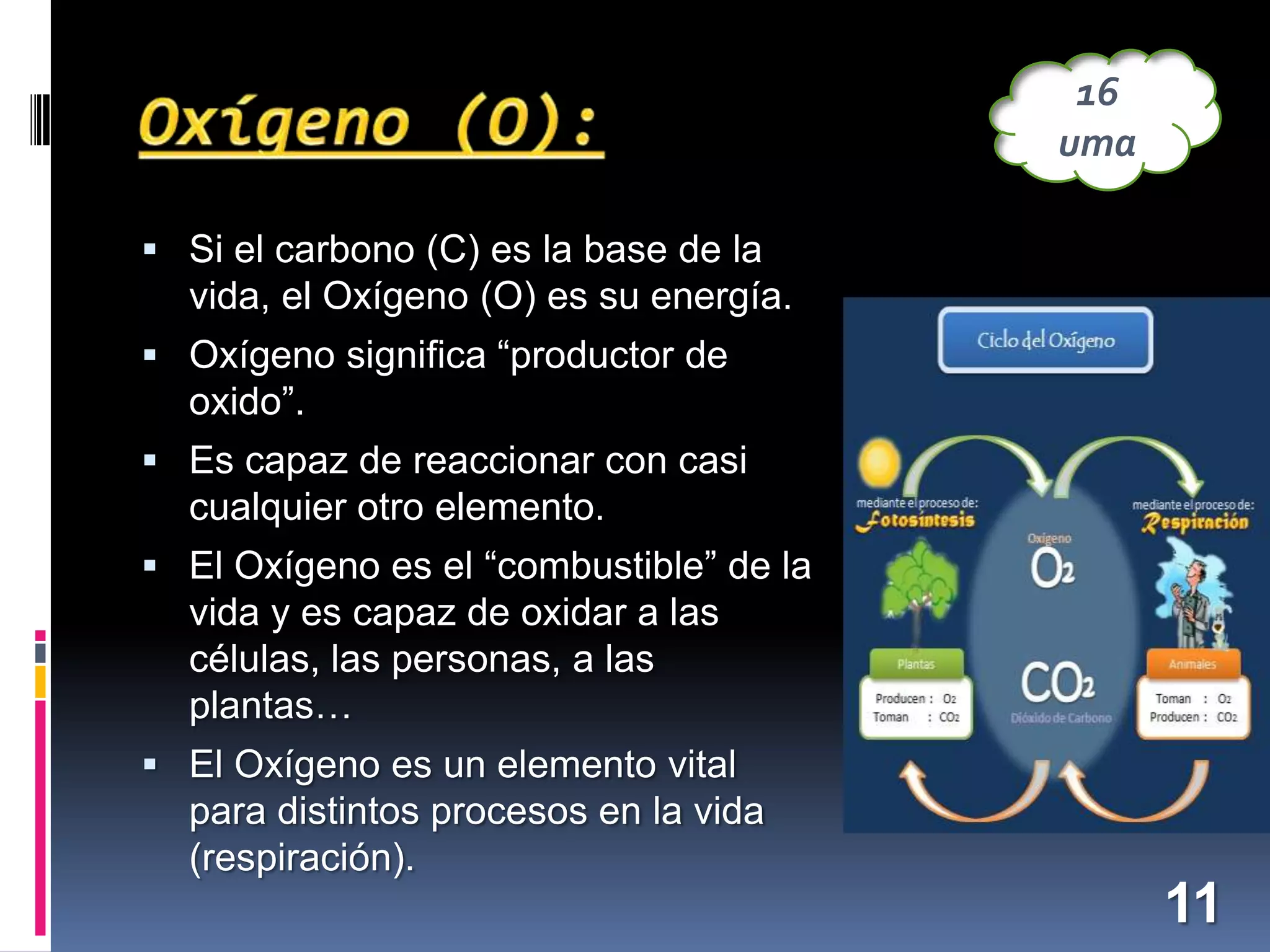
El documento resume los conceptos básicos sobre la composición de la materia desde la antigua Grecia hasta la ciencia moderna. Explica que la materia está compuesta por átomos, las partículas que los componen (protones, neutrones, electrones), y cómo los átomos de diferentes elementos se unen para formar moléculas y sustancias. También describe algunos elementos químicos importantes como el oxígeno, el carbono, el hidrógeno y su papel en procesos vitales y en la composición de la Tierra y el universo