15. leyes de gases
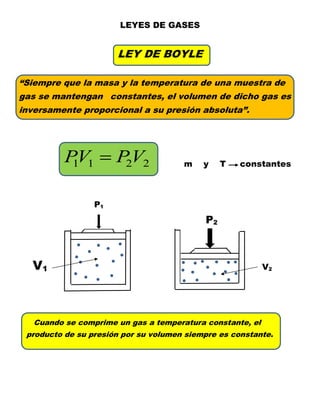
- 1. LEYES DE GASES LEY DE BOYLE “Siempre que la masa y la temperatura de una muestra de gas se mantengan constantes, el volumen de dicho gas es inversamente proporcional a su presión absoluta”. 2 2 1 1 V P V P = m y T constantes P1 P2 V1 V2 Cuando se comprime un gas a temperatura constante, el producto de su presión por su volumen siempre es constante.
- 2. LEY DE CHARLES “ Mientras la masa y la presión de un gas se mantengan constantes, el volumen de dicho gas es directamente proporcional a su temperatura absoluta”. 2 2 1 1 T V T V = m y P constantes T1 P2 P1 V1 V2 T2
- 3. LEY DE GAY-LUSSAC “ Si el volumen de una muestra de gas permanece constante, la presión absoluta de dicho gas es directamente proporcional a la temperatura absoluta”. 2 2 1 1 T P T P = m y V constantes V1 = V2 P1 P2 T1 T2
- 4. EJERCICIOS RESUELTOS ¿Qué volumen de gas hidrógeno a presión atmosférica se requiere para llenar un tanque de 5000 cm3 bajo una presión manométrica de 530 Kpa? DATOS: V1= P1. V1= P2. V2 P1= 101.3 Kpa. V2= 5000 cm3 P2= 530 Kpa. + 101.3Kpa= 631.3Kpa. 3 3 1 2 2 1 92 . 159 , 31 ) 3 . 101 ( ) 5000 ).( 3 . 631 ( . cm Kpa cm Kpa P V P V = = = Un globo grande lleno de aire tiene un volumen de 200 litros a 0 ˚C. ¿Cuál será su volumen a 57˚ C si la presión no cambia? DATOS: V1= 200 litros V2= T1= 0˚C + 273 = 273K T2= 57˚C + 273 = 330K 2 2 1 1 T V T V = litros K K litros T T V V 75 . 241 ) 273 ( ) 330 )( 200 ( ) ( ) )( ( 1 2 1 2 = = =
- 5. El neumático de un automóvil se infla a una presión manométrica de 30 lb/pulg2 en un momento en que la presión de los alrededores es de 14.4 lb/pulg2 y la temperatura es de 70˚F. Después de manejarlo, la temperatura del aire del neumático aumenta a 100˚F. Suponga que el volumen del gas cambia sólo ligeramente, ¿Cuál es la nueva presión manométrica en el neumático? DATOS: P1= 30 lb/pulg2 + 14.4 lb/pulg2 = 44.4 lb/pulg2 Patm= 14.4 lb/pulg2 T1= 70˚F + 460 = 530R T2= 100˚F + 460= 560R P2= 2 2 1 1 T P T P = 2 2 1 2 1 2 lg 91 . 46 ) 530 ( ) 560 )( lg 4 . 44 ( ) )( ( pu lb R R pu lb T T P P = = = 2 2 2 lg 51 . 32 lg 4 . 14 lg 91 . 46 pu lb pu lb pu lb P P P atm abs man = − = − =
- 6. LEY GENERAL DEL ESTADO GASEOSO 2 2 2 1 1 T V P T V P = m constante 2 2 2 2 1 1 1 1 T m V P T m V P = m variable
- 7. Ejercicio resuelto Un tanque para oxígeno con un volumen interior de 20 litros se llena con ese gas bajo una presión absoluta de 6x106 N/m2 a 20˚C. El oxígeno se va a usar en un avión para grandes alturas, donde la presión absoluta es 7x104 N/m2 y la temperatura es -200 C. ¿Qué volumen de oxígeno será capaz de suministrar el tanque en esas condiciones? DATOS: V1= 20 litros P1= 6x106 N / m2 T1 = 20 +273 = 293 K P2= 7x104 N / m2 T2= -20 + 273 = 253 K V2 = 2 2 2 1 1 1 T V P T V P = ) 293 )( 10 7 ( ) 253 )( 20 )( 10 6 ( 2 4 2 6 1 2 2 1 1 2 K m N x K litros m N x T P T V P V = = V2= 1480.25 litros
- 8. La lectura de la presión manométrica en un tanque para el almacenamiento de helio indica 2000 lb/pulg2 cuando la temperatura es de 270 C. Durante la noche, hay una fuga en el recipiente y a la mañana siguiente se tienen 1500 lb/pulg2 a una temperatura de 170 C. ¿Qué porcentaje de la masa original de helio permanece dentro del recipiente? DATOS: V1=V2 P1= 2000 + 14.7 = 2014.7 lb/pulg2 T1= 27 + 273 = 300K P2= 1500 + 14.7 = 1514.7 lb/pulg2 T2= 17 + 273 = 290K 2 2 2 2 1 1 1 1 T m V P T m V P = 778 . 0 ) 290 )( lg 7 . 2014 ( ) 300 )( lg 7 . 1514 ( 2 2 2 1 1 2 1 2 = = = K pu lb K pu lb T P T P m m El 77.8% del helio todavía permanece en el tanque
- 9. MASA MOLECULAR Y MOL La masa atómica de un elemento es la masa de un átomo de dicho elemento comparado con la masa de un átomo de carbono tomado como 12 unidades de masa atómica. Sobre ésta base: masa atómica del hidrógeno es 1u masa atómica de oxígeno es 16u Una molécula consiste en una combinación química de dos o más átomos. La masa molecular M es la suma de las masas atómicas de todos los átomos que componen la molécula. Por ejemplo: Una molécula de O2 M = 16x2 = 32u Una molécula de CO2 M = 12x1 = 12 16x2 = 32 M = 44 u Una mol es la cantidad de una sustancia que contiene el mismo número de partículas que el número de átomos que hay en 12g de C 12. Una mol es la masa en gramos numéricamente igual a la masa molecular de una sustancia
- 10. Por ejemplo: 1 mol de hidrógeno (H2) es 2 gr 1 mol de oxígeno (O2) es 32 gr 1 mol de dióxido de carbono (CO2) es 44 gr En otras palabras: 2gr de H2 , 32 gr de O2 y 44 gr de CO2 tienen el mismo número de moléculas. A este número NA se le conoce como número de Avogadro. Número de Avogadro ( NA) es la razón del número de moléculas “N” al número de moles “n” n N NA = mol Moléculas mol moléculas x NA 23 10 023 . 6 = moles mol gr gr M m n = = =
- 11. EJERCICIO RESUELTO (a) ¿Cuántas moles de gas hay en 200gr de CO2? (b) ¿Cuántas moléculas hay? La masa molecular del CO2 es de 44 u o 44 gr/mol moles mol gr gr M m n 5 . 4 44 200 = = = A N N n = moléculas x mol moléculas x moles N n N A 24 23 10 71 . 2 ) 10 023 . 6 )( 5 . 4 ( . = = = LEY DEL GAS IDEAL Si se sustituye el número de moles (n) por la masa (m) tenemos: 2 2 2 2 1 1 1 1 T n V P T n V P = Una expresión alternativa R nT PV =
- 12. R constante universal de los gases R = 8.314 J / mol . K = 0.0821 lts. Atm / mol . K = 1.99 cal / mol . K nRT PV = RT M m PV =
- 13. EJERCICIOS RESUELTOS Determine el volumen de una mol de cualquier gas ideal en condiciones normales de temperatura (00 C=273K) y de presión (1 atm=101.3Kpa). 3 0224 . 0 4 . 22 1 ) 273 )( . . 0821 . 0 )( 1 ( . . m litros atm K K mol atm lts mol P T R n V = = = = ¿Cuántos gramos de oxígeno ocuparán un volumen de 1.6m3 a una presión de 200 Kpa y a una temperatura de 27 0 C? RT M m PV = Kg gr K K mol m N mol gr m m N RT PVM m 1 . 4 52 . 4105 ) 300 )( . . 314 . 8 ( ) 32 )( 6 . 1 )( 200000 ( 3 2 = = = =
- 14. EJERCICIOS PROPUESTOS LEYES GENERALES DE LOS GASES: ESTADO INICIAL Y FINAL 1.- Un recipiente flexible se llena con 2 m3 de gas a una presión absoluta de 400 Kpa. Si el volumen se incrementa lentamente hasta 5 m3 a temperatura constante sin que cambie su masa, ¿Cuál es la nueva presión absoluta? R= 160Kpa. 2.-Un neumático de automóvil tiene una presión manométrica en su interior de 30 lb/pulg2 una mañana en que la temperatura del aire es de 4 0 C. Después de usarse el auto durante varias horas, la temperatura del aire dentro del neumático se eleva a 50 0 C. suponga que el volumen es esencialmente constante y que no hay fuga de aire de los neumáticos. ¿Cuál es la nueva presión manométrica? 3.-Un tanque con una capacidad de 14 litros contiene gas helio a 24 0 C bajo una presión manométrica de 2700 Kpa. (a) ¿ Cuál será el volumen de un globo lleno de este gas si el helio se dilata a una presión absoluta interna de 1 atm y la temperatura desciende a – 35 0 C. (b) suponga que ahora el sistema regresa a su temperatura original (24 0 C). ¿Cuál es el volumen final del globo? R= (a) 310 litros, (b) 387 litros. 4.-Un tanque de 6 litros contiene una muestra de gas bajo una presión absoluta de 600 Kpa y una temperatura de 57 0 C. ¿Cuál será la nueva presión si la misma muestra de gas se coloca en un recipiente de 3 litros a 7 0 C? 5.-Un compresor de aire toma 2 m3 de aire a 20 0 C y a presión atmosférica (101.3Kpa). Si el compresor descarga en un tanque de o.3 m3 a una presión absoluta de 1500 Kpa. ¿Cuál es la temperatura del aire descargado? R= 651K 6.-Si 0.8 litros de un gas a 10 0 C se calienta a 90 0 C a presión constante, ¿Cuál será el nuevo volumen? 7.-Un tanque de acero se llena de oxígeno. Una tarde cuando la temperatura es de 27 0 C, el manómetro colocado en la parte superior del tanque indica una presión de 400 Kpa. Durante la noche hay una fuga en el tanque. La mañana siguiente un técnico observa que la presión manométrica es de sólo 300 Kpa y la temperatura es de 150 C. ¿Qué porcentaje del gas original permanece en el tanque? R= 83.4% 8.-Cinco litros de gas a una temperatura absoluta de 200 Kpa y una temperatura de 250 C se calientan a 600 C y la presión absoluta se reduce a 120Kpa. ¿Qué volumen ocupará el gas en estas condiciones? MASA MOLECULAR Y MOL 9.-¿Cuántas moles de gas hay en 400gr de gas nitrógeno?. La masa molecular del nitrógeno es de 28 g/mol. ¿Cuántas moléculas hay en esta muestra’
- 15. R= 14.3 mol, 8,6x10 24 moléculas 10.-¿Cuántas moles hay en 0.3 kg de agua (H2O)? ¿ Cuántas moléculas? 11.- La masa molecular de una molécula de CO2 es de 44g/mol. ¿Cuál es la masa de una sola molécula de CO2? R= 7.31x10-26 Kg. 12.-¿Cuál es la masa de 4 moles de una muestra de aire (M= 29 g / mol)? LEY DEL GAS IDEAL 13.-Tres moles de un gas ideal bajo una presión de 300 Kpa se confinan a un volumen de 0.026m3 . ¿Cuál es la temperatura del gas en 0 C? R= 39.7 0 C 14.-Un tanque de 16 litros contiene 0.2 kg de aire (M=29 g/mol) a 27 0 C. (a) ¿Cuántas moles de aire hay en el tanque?. (b) ¿Cuál es la presión absoluta en Kpa? 15.-¿Cuántos gramos de gas nitrógeno (M=28 gr/mol) ocuparán un volumen de 2000 litros a una presión absoluta de 202 Kpa y a una temperatura de 80 0 C? R=3.85 Kg 16.-¿Qué volumen ocupan 8 gr de oxígeno (M=32 g/mol) a temperatura y presión normales (PTS)? 17.-Un frasco de 2 litros se llena con nitrógeno (M= 28 g/mol) a 27 0 C y a 1 atm de presión absoluta. Se abre al aire una llave de paso que está en la parte superior del tanque y el sistema se calienta a una temperatura de 127 0 C. Luego se cierra la llave de paso y se permite que el sistema regrese a 27 0 C. (a) ¿Qué masa de nitrógeno hay en el frasco? (b) ¿Cuál es la presión absoluta final? R= 1.71gr, 0.75 atm