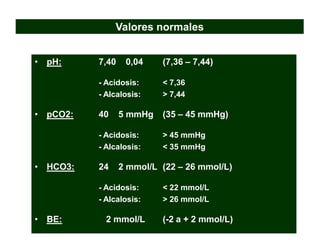
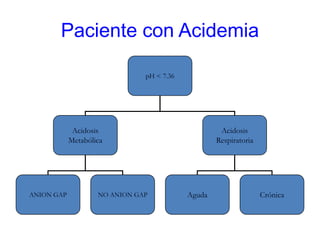
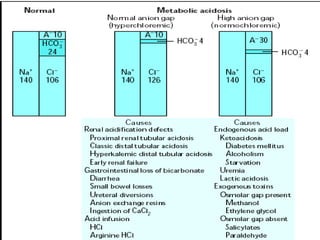
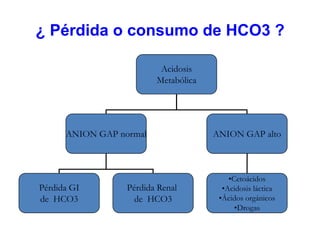
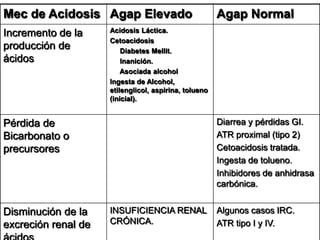
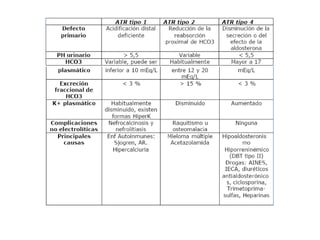
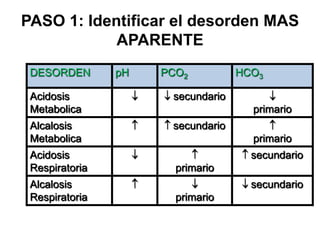
Este documento describe la acidosis metabólica, incluyendo sus valores normales, mecanismos de generación, causas principales como la acidosis láctica y cetoacidosis, y tratamiento. Define la acidosis metabólica como una alteración con pH arterial bajo y reducción de HCO3- acompañada de hiperventilación compensatoria. Explica cómo se calcula el anion gap y cómo esto ayuda a diferenciar los tipos de acidosis metabólica.

















![PASO 2: Aplicar fórmulas para ver
compensación
• AcMet: PCO2=1.5x[HCO3]+8 (+/-2)
• Por cada mmol HCO3 ----pCO2 1.5 mmHg
• AlcMet: PCO2=40+0.7x[HCO3medido-
HCO3normal] (+/-5)
• AcRes:
– Aguda: HCO3 por cada PCO2
– Cronica: HCO3 por cada PCO2
• AlcRes:
– Aguda: HCO3 por cada PCO2
– Cronica: HCO3 por cada PCO2](https://image.slidesharecdn.com/acidosismetablicahalf-120520212721-phpapp02/85/Acidosis-metabolica-25-320.jpg)













![Regla
(Cálculo del PCO2 compensatorio)
• Acidosis Metabólica:
PCO2 = [( HCO3 x 1.5) + 8] +/- 2](https://image.slidesharecdn.com/acidosismetablicahalf-120520212721-phpapp02/85/Acidosis-metabolica-39-320.jpg)
![Solución
Ejemplo 1 • Acidosis metabólica
• Anion-Gap:
– Na-(Cl+HCO3)
– pH=7.31
– 123-(99+5)=19
– PCO2=20
– HCO3=5 • Anion-Gap alto
– Na=123 • PCO2 compensatorio
– Cl=99 – [(HCO3x1.5)+8] +/-2
– 15.5 +/-2=17.5 y 13.5
– Acidosis respiratoria
• THE final: Acidosis mixta.](https://image.slidesharecdn.com/acidosismetablicahalf-120520212721-phpapp02/85/Acidosis-metabolica-40-320.jpg)
![Solución
Ejemplo 2 • Acidosis metabólica
• Anion-Gap:
– Na-(Cl+HCO3)
– pH=7.2
– 130-(80+10)=40
– PCO2=25
– HCO3=10 • Anion-Gap alto
– Na=130 • PCO2 compensatorio
– Cl=80 – [(HCO3x1.5)+8] +/-2
– 23+/-2=25 y 21
– PCO2 compensa trastorno.
• THE final: Acidosis
metabólica Anion-Gap
alto](https://image.slidesharecdn.com/acidosismetablicahalf-120520212721-phpapp02/85/Acidosis-metabolica-41-320.jpg)
