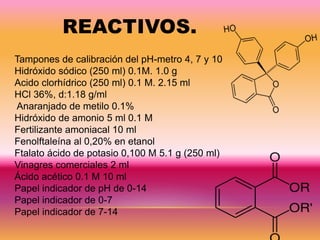
Este documento presenta los detalles de una práctica de laboratorio realizada por el Equipo #4 en el laboratorio de Química Analítica. La práctica involucró la titulación de ácidos y bases débiles para determinar la constante de disociación y el punto de equilibrio. Se midió la concentración de ácido acético en un vinagre comercial usando una base fuerte normalizada y curvas de titulación. Los resultados mostraron que el vinagre contenía un 5.56% de ácido acético.







![CALCULO DE PH INICIAL.
pH = -log [HCl]
pH= -log [5,2]= -0.71
pH=-log[5.3]= -0.72
pH=-log[5.3]= -0.72
1
2
3](https://image.slidesharecdn.com/analitcarep2-170506172732/85/Analitca-rep-2-9-320.jpg)


