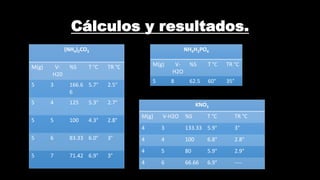
Este documento presenta los detalles de un experimento de laboratorio realizado por 6 estudiantes de biotecnología para estudiar cómo varía la solubilidad de sales en agua con la temperatura. El objetivo era relacionar la solubilidad con el equilibrio entre el soluto disuelto y no disuelto en el momento de saturación, y caracterizar las temperaturas de cristalización. Se midió la solubilidad de varias sales a diferentes temperaturas, disolviéndolas en tubos de ensayo calentados en un baño maría, y anot