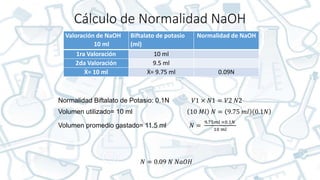
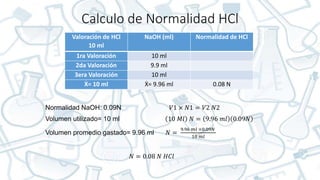
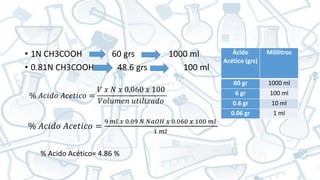
Este documento presenta el reporte de una práctica de laboratorio sobre equilibrio ácido-base. Se enumeran 6 estudiantes que realizaron la práctica y se describe el objetivo de determinar la constante de disociación y el punto de equilibrio de ácidos y bases débiles mediante titulaciones. Se presentan los procedimientos de preparación de soluciones patrón de NaOH y HCl, y la valoración de muestras de ácido búfalo, vinagre e hidróxido de amonio para calcular sus normalidades.