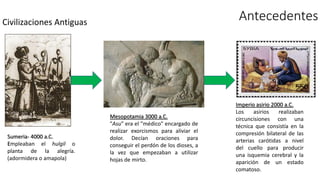
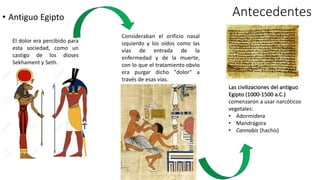
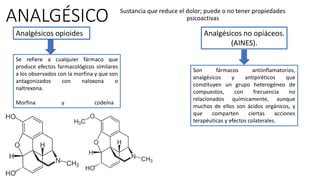
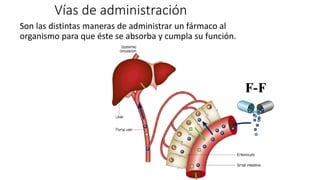
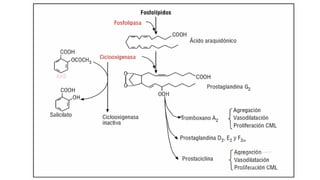
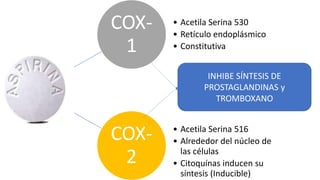
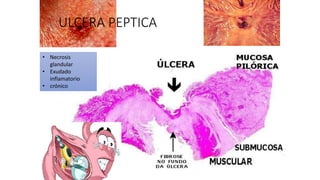
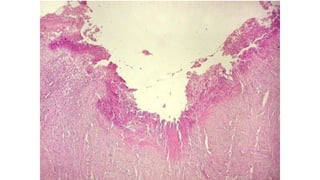
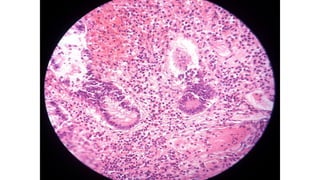
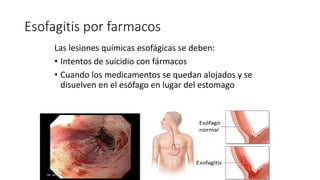
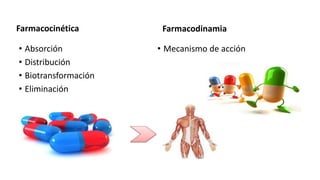
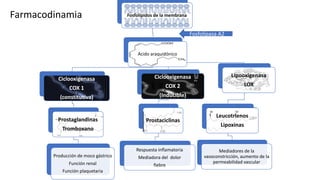
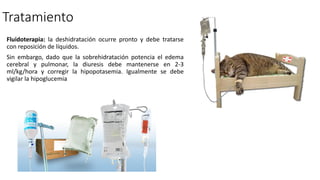
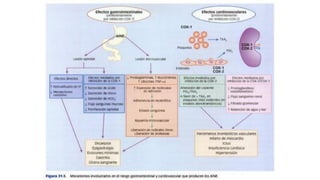
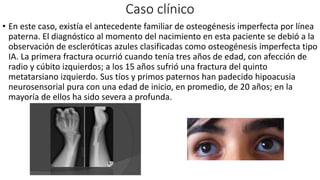
Este documento describe la historia del tratamiento del dolor desde las civilizaciones antiguas hasta el desarrollo moderno de los antiinflamatorios no esteroideos como la aspirina. Se detalla el uso de plantas medicinales por parte de las primeras sociedades y el descubrimiento de analgésicos como la morfina y la aspirina. Asimismo, explica los mecanismos de acción de los AINEs a través de la inhibición de las enzimas ciclooxigenasas.