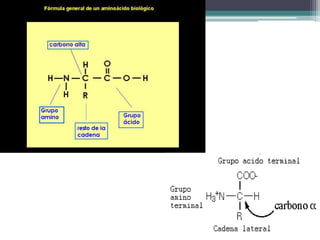
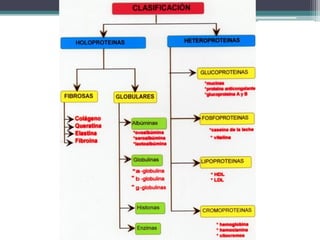
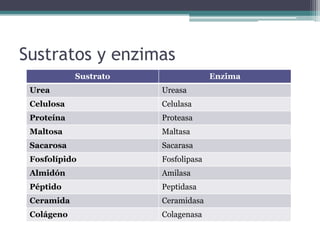
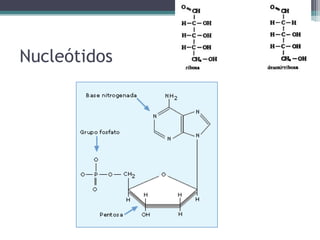
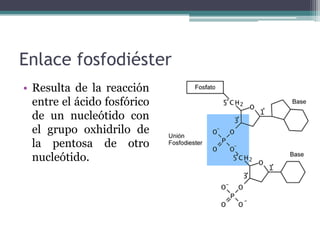
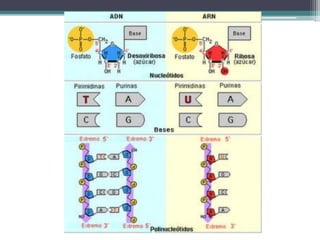
El documento resume los principales conceptos sobre proteínas, ácidos nucleicos y vitaminas. Explica que las proteínas están formadas por aminoácidos unidos por enlaces peptídicos, y cumplen funciones estructurales, de transporte, hormonales, defensivas, contráctiles y catalíticas. Los ácidos nucleicos almacenan y transmiten la información genética a través de la secuencia de sus nucleótidos. Las vitaminas son compuestas orgánicos esenciales que deben ser obtenidos de la dieta y