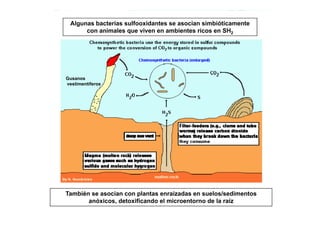
El ciclo del azufre implica varias transformaciones entre estados de oxidación del azufre mediadas por procesas biológicos y químicos. Estos incluyen la oxidación del azufre reducido (H2S, S0) a sulfato (SO42-) por bacterias quimiolitotróficas y fototróficas, y la reducción del sulfato a azufre reducido por bacterias sulfato-reductoras. Estas transformaciones juegan un papel importante en la movilización de nutrientes, detoxificación de H2S, y control