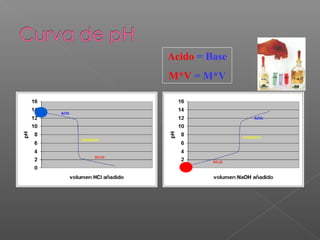
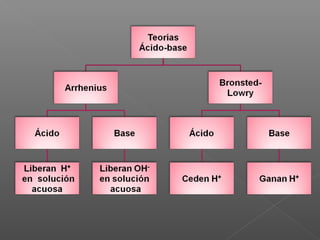
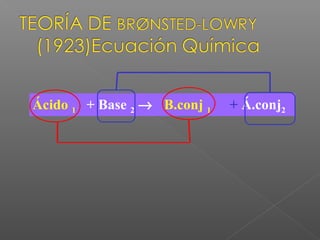
El documento describe las teorías ácido-base, incluyendo la definición de ácidos, bases, electrolitos fuertes y débiles. Explica cómo se calculan el pH y pOH de una solución, y cómo determinar si una solución es ácida, básica o neutra. También cubre los cálculos relacionados con la concentración de iones H+ e OH- y ejemplos de reacciones ácido-base.

















![como el logaritmo negativo de la
concentración de ion hidronio en una
disolución acuosa:
pH = -log [H+
]
pH + pOH = 14
El valor del pOH es igual al logaritmo
negativo de la concentración de ion
hidroxilo en una disolución acuosa:
pOH = -log [OH-
]
pH + pOH = 14](https://image.slidesharecdn.com/comn10cidobase-101128182745-phpapp01/85/Acido-Base-21-320.jpg)