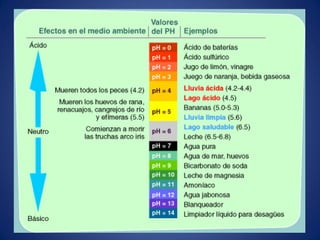
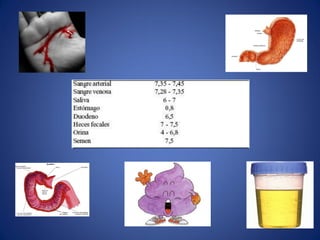
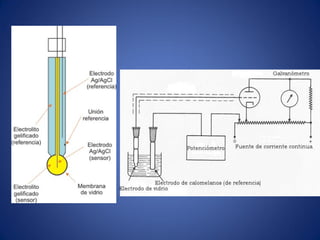
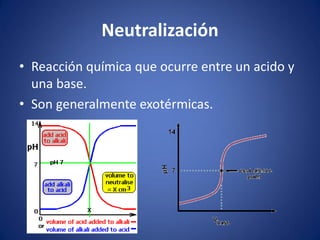
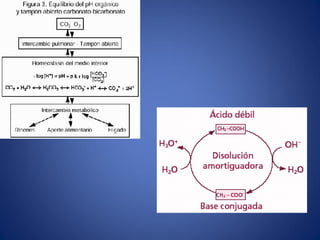
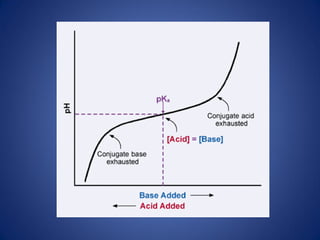
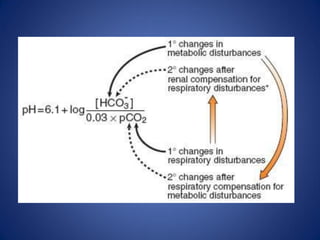
El documento aborda la ionización del agua, su importancia en la función celular y presenta constantes de equilibrio. Se analizan ejemplos de cálculos de concentración de iones en soluciones y se introduce la escala de pH, que se basa en el producto iónico del agua. Además, se discuten las reacciones de neutralización y el papel de amortiguadores biológicos en la regulación del pH.

![Ionización del agua
• Tiende a ionizarse: [H+] y [OH-]
• Presenta una cte de equilibrio.
• Crucial en la función celular.
• Cte de equilibrio:
H2O H+ OH-+
A + B C D+
Keq =[C] [D]
[A] [B]
PRODUCTOS
REACTIVOS](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-2-320.jpg)
![• Las constantes de equilibrio son fijas y
características de cada reacción química.
• Están dadas a una determinada temperatura.
• Grado de ionización del agua (25°C) = 1 de
cada 107 moléculas se encuentra ionizada.
Keq = [H+][OH-]
[H2O]](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-3-320.jpg)
![• La concentración del agua (25°C): 55.5M
• Keq se han determinado mediante medidas de
conductividad electrica y se ha calculado en
1,8 x 10-16 M (25°C)
Keq = [H+][OH-]
[55.5M]
(55.5M)(Keq) = [H+] [OH-] = Kw
Producto iónico
del agua](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-4-320.jpg)
![• El producto [H+] [OH-] es igual 1 x 10-14 M2
• Si las [H+] y [OH-] son iguales
(55.5M)(1.8 x 10-16 M) = [H+] [OH-] = Kw
99.9 x 10-16 M2 = [H+] [OH-]
1.0 x 10-14 M2 = [H+] [OH-] = Kw
Kw = [H+] [OH-] = [H+]2
[H+] = √Kw = √1 x 10-14 M2
[H+] = [OH-] = 10-7 M](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-5-320.jpg)

![Problemas ilustrativos
• El producto ionico del agua permite calcular la
concentración de H+, dad la concentración de
OH- y viceversa; los siguientes problemas lo
demuestran.
1. ¿Cuál es la concentración de H+ en una
solución de NaOH 0.1 M?
Kw = [H+] [OH-]
Despejando [H+] da
[H+] = Kw = 1 x 10-14 M2
[OH-] 0.1 M
[H+] = 10-14 M2 = 10-13 M
10-1M](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-7-320.jpg)
![2. ¿Cuál es la concentración de OH- en una
solución en la que la concentración de H+ es
0.00013 M?
Kw = [H+] [OH-]
Despejando [OH-] da
[H+] = Kw = 1 x 10-14 M2
[H+] 0.00013 M
[H+] = 1 x 10-14 M2 = 7.7 x 10-11 M
1.3 x 10-4 M](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-8-320.jpg)
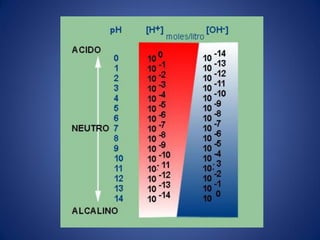
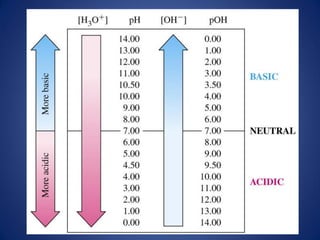
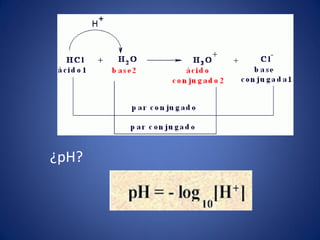
![La escala de pH representa las
concentraciones de H+ y OH-
• El producto ionico del agua Kw es la base de la
escala de pH.
• El término pH se define mediante la expresión
• Para una solución neutra a 25°C, [H+] = 1.0 x
10-7 M.
pH = - log 1 = - log [H+]
[H+]
pH = - log 1 = - log [1 x 107] = log 1.0 + log 107
[1 x 10-7]
pH = 0 + 7.0 = 7.0](https://image.slidesharecdn.com/semana3ph-140322165909-phpapp01/85/pH-potencial-de-Hidrogeno-H-9-320.jpg)