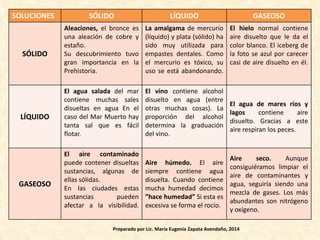
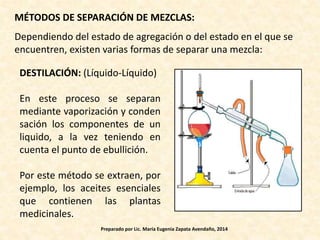
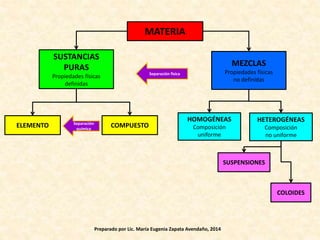
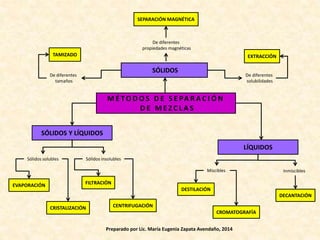
Este documento presenta tres objetivos relacionados con la clasificación de la materia en elementos, compuestos, mezclas y soluciones. Explica las características de estas sustancias puras y cómo se pueden diferenciar. También describe varios métodos para separar mezclas como la destilación, filtración y decantación.