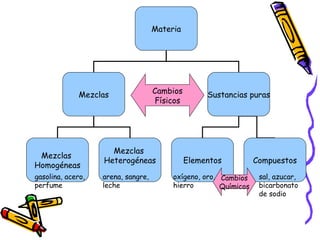
Este documento describe las diferencias entre mezclas, elementos y compuestos. Explica que una mezcla es la combinación de dos o más sustancias puras que mantienen sus propiedades individuales, mientras que los elementos y compuestos no pueden descomponerse en sustancias más simples. También cubre los tipos de mezclas, la tabla periódica de los elementos, las leyes de proporciones definidas y múltiples que rigen la composición química de los compuestos.