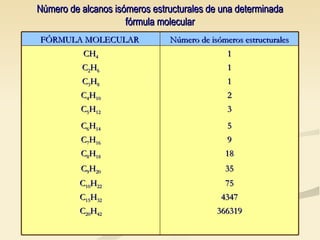
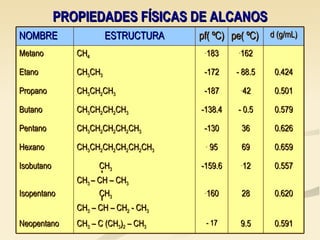
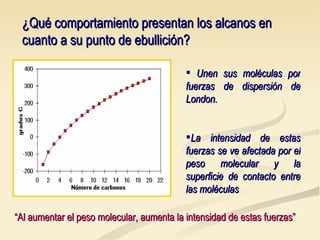
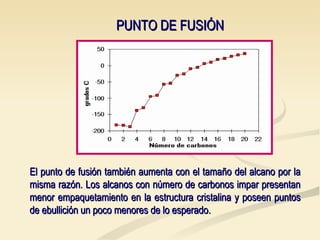
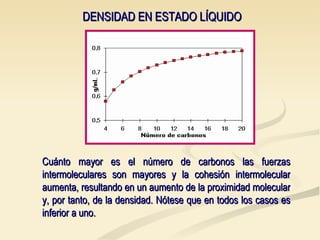
Este documento describe las propiedades físicas de los alcanos y cómo varían en función de su estructura molecular. Los alcanos ramificados tienen puntos de ebullición más bajos que los alcanos lineales debido a que sus moléculas tienen una superficie de contacto menor, lo que reduce las fuerzas intermoleculares. Tanto el punto de ebullición como el punto de fusión aumentan con el número de carbonos de cada alcano, ya que las mayores moléculas experimentan fuerzas intermoleculares más intensas. Además, la densidad