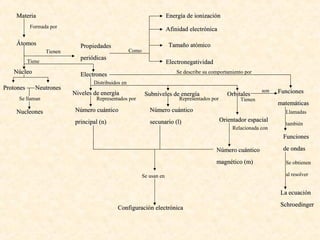
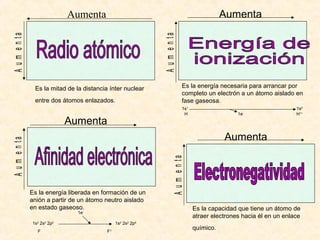
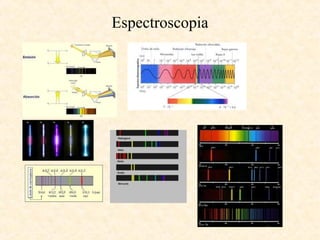
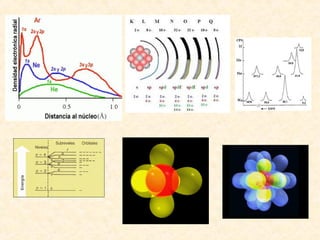
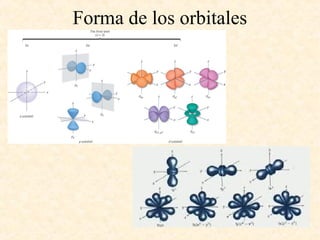
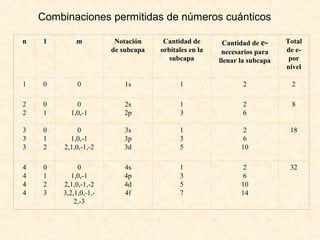
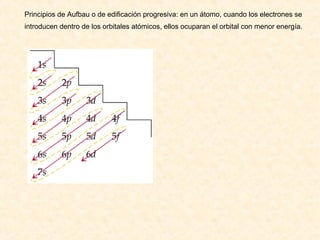
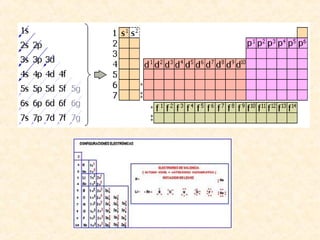
Este documento describe conceptos fundamentales de la estructura atómica. Explica que los átomos están formados por protones y neutrones en el núcleo y electrones distribuidos en niveles y subniveles de energía. Los niveles se representan por el número cuántico principal n y los subniveles por el número cuántico secundario l, que determina la forma de los orbitales atómicos.