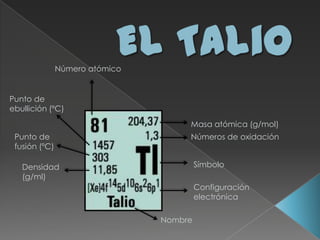
El documento proporciona información sobre el talio, incluyendo su descubrimiento, propiedades físicas y químicas, isótopos, compuestos y usos. William Crookes descubrió el talio en 1862 al observar líneas verdes en el espectro de emisión de un ácido sulfúrico impuro. Es un metal blando, maleable y pesado que se oxida fácilmente al aire. Forma compuestos como el sulfato de talio, que se ha usado históricamente como veneno. Algunos usos del tal