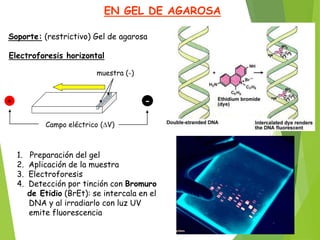
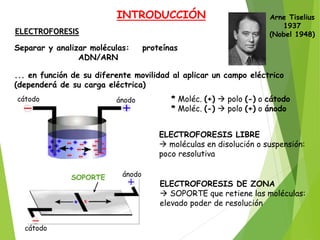
La electroforesis separa y analiza moléculas como proteínas y ácidos nucleicos en función de su movilidad cuando se aplica un campo eléctrico, dependiendo de su carga eléctrica. Existen dos tipos principales: la electroforesis libre, donde las moléculas se mueven en disolución con poca resolución, y la electroforesis de zona, donde un soporte retiene las moléculas ofreciendo un alto poder de resolución. La electroforesis de proteínas se realiza comúnmente en geles de acrilamida





![EN GEL DE POLIACRILAMIDA (PAGE)
Electroforesis vertical
Soporte: (restrictivo) Gel de Poliacrilamida
* Polimerización de dos componentes: Acrilamida + Bisacrilamida
* Variación de la concentración variación del tamaño de poro
[poliacrilamida] tamaño poro
1. Preparación del gel
2. Montaje de la cubeta
3. Aplicación de la muestra
4. Electroforesis
5. Detección por tinción:
Azul de Coomassie
Sales de plata](https://image.slidesharecdn.com/electroforesis-200929195032/85/Electroforesis-7-320.jpg)