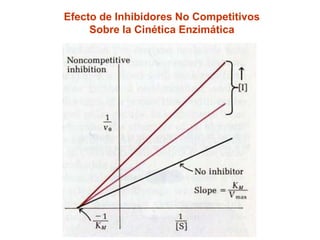
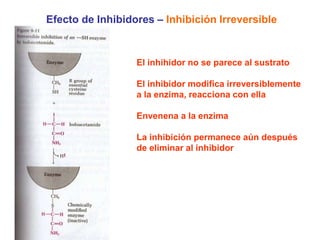
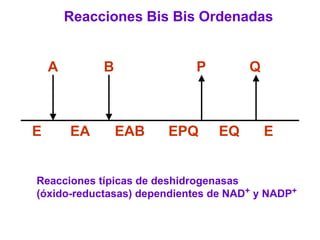
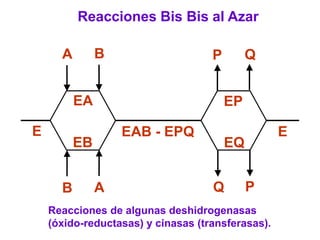
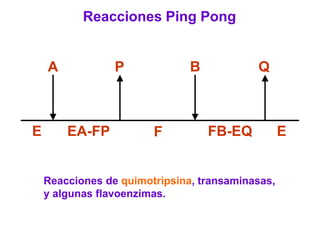
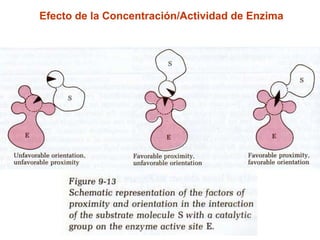
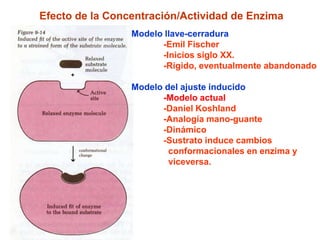
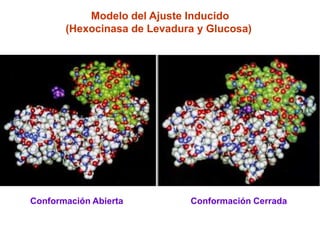
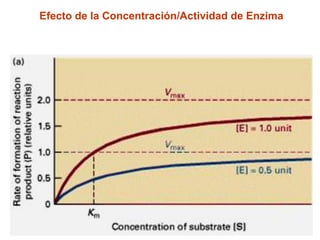
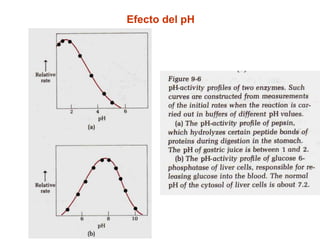
Este documento describe varios factores que afectan la actividad enzimática, incluyendo la temperatura, el pH, la concentración de sustrato e inhibidores. También explica los modelos de unión del sustrato a la enzima y los tipos de inhibición enzimática.


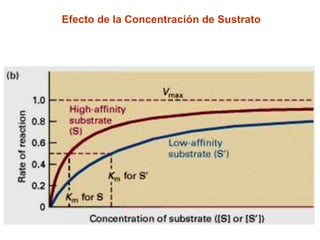
![Efecto de la Concentración de Sustrato
[S]
V = Vmax
[S] + Km
V
[S]](https://image.slidesharecdn.com/enzimas-2-120927131621-phpapp01/85/Enzimas-2-8-320.jpg)
![Cinética Enzimática
k1 kcat
E+S ES E+P
k2
Ecuación de Michaelis-Menten
[S] V= Velocidad de reacción
V = Vmax
[S] + Km Vmax = Velocidad máxima
[S] = Conc. de sustrato
Km = Constante de Michaelis
Medida de la afinidad de la
enzima por el sustrato.](https://image.slidesharecdn.com/enzimas-2-120927131621-phpapp01/85/Enzimas-2-9-320.jpg)

![Efecto de la Concentración de Sustrato
Representación de Representación doble recíproca
Michaelis-Menten de Lineweaver-Burk
Difícil calcular Vmax Permite calcular Vmax
1 Km 1 1
[S] = +
V = Vmax V Vmax [S] Vmax
[S] + Km
y = m x + b](https://image.slidesharecdn.com/enzimas-2-120927131621-phpapp01/85/Enzimas-2-12-320.jpg)

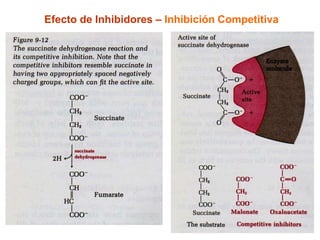
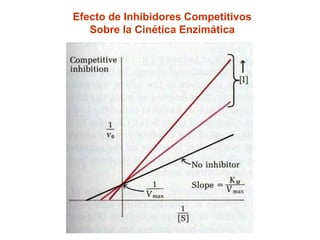
![Efecto de Inhibidores – Inhibición Competitiva
El inhihidor se parece al sustrato (análogo del sustrato)
El inhibidor se une al sitio activo de la enzima
Afecta la unión del sustrato (compite con él)
Afecta Km (afinidad)
No afecta Vmax
No afecta la capacidad de la enzima de transformar al S en P
Es Reversible: Si se elimina al inhibidor, la inhibición cesa
Al aumentar la [S], la inhibición disminuye](https://image.slidesharecdn.com/enzimas-2-120927131621-phpapp01/85/Enzimas-2-16-320.jpg)